Biorex Kutató és Fejlesztő Rt., Veszprém,1 PharmaProject Kft., Budapest2
ÚJABB LEHETŐSÉG A DIABETESZES NEPHROPATHIA KEZELÉSÉRE. BESZÁMOLÓ A HŐSOKKFEHÉRJE-KOINDUKÁLÓ BRLP-42-VEL (BIMOCLOMOL) VÉGZETT, HAT HÓNAPOS, KETTŐS VAK, RANDOMIZÁLT, FÁZIS II/A KLINIKAI VIZSGÁLATRÓL
Péterfai Éva dr.,1* Pálfi Sándor dr.,1 Vitrai József dr.,2 a BRLP-42 vizsgálat centrumai, Kurucz István dr.,1** Korányi László dr. 1*
Összefoglalás
A szerzők egy új hatásmechanizmusú vegyület, a bimoclomol (Biorex Rt., Veszprém) randomizált, kettős vak, placebóval kontrolállt, multicentrikus, hat hónapos fázis II/a vizsgálatáról számolnak be. A vizsgálat során cukorbetegek estében figyelték az albuminuria mértékének változását a kezelés során. A hat hónapos bimoclomol-kezelés nemcsak leállította a nephropathia progresszióját (p=0,0004), de az enyhébb proteinuriás csoportban (albuminuria <150 mg/nap) az albuminuria szignifikáns csökkenését is eredményezte (p=0,0211). A bimoclomol hatásmechanizmusa részleteiben még nem ismert, hősokkgén-koindukáló hatása van, azaz stresszhelyzetben fokozza a sejtekben a hősokk- vagy stresszfehérjegének átírását. Ezek a fehérjék nemcsak a sejtek strukturális és funkcionális épségéért felelősek, de intracelluláris szintjük nagyon szoros korrelációt mutat a sejtek zsír- és cukorfelhasználásával. A klinikai vizsgálat eredménye arra utal, hogy a bimoclomol egy új hatásmechanizmusú, a diabeteszes veseszövődmény kezelésében használható ígéretes vegyület, mely biztonságos, jól tolerálható szernek bizonyult.
Kulcsszavak: bimoclomol, diabeteszes nephropathia, albuminuria, hősokkfehérjék, hősokkfehérjekoindukció
A possible new way to treat diabetic nephropathy. Report of the double blind, randomized, placebo controlled, six month long phase II/a clinical study with the heat shock protein coinducer BRLP-42 (bimoclomol)
Summary
The effect of six months bimoclomol (Biorex R&D. Co Veszprem, Hungary) treatment was investigated on the magnitude of albuminuria of diabetic patients in a phase II/a, multicentre, randomised, placebo controlled, double blind clinical trial. bimoclomol treatment not only reduced significantly the progression of albuminuria (p=0.0004), but in the group of patients with milder albuminuria (<150 mg/day) even a significant improvement (p=0.0211) was observed. The exact mode of action of bimoclomol has not been known. It has already been proved that bimoclomol is a chaperone (stress or heat shock-protein, HSP) coinducer. During stress situation it increases the expression of the heat shock protein genes. Stress proteins play extreme important role in cell life. They are not only responsible for structural and functional integrity of cells, but are in close correlation with lipid and glucose metabolism of the cell. The result of this clinical study suggests bimoclomol has new mode of action, it is a promising drug candidate in the treatment of diabetic nephopathy and it administration is safe and well tolerated.
Keywords: bimoclomol, diabetic nephropathy, albuminuria, heat shock protein, heat shock protein coinducer
A felismert cukorbetegek, elsősorban a felnőttkori, rendszerint elhízással társuló 2-es típusú cukorbetegek száma ijesztő mértékben emelkedik. Míg a világon a 2000. évben 147 millió cukorbeteget tartottak számon, addig 2010-ben 215, 2030-ban 300 millió 2-es típusú cukorbetegre számítanak. Az iparilag fejlett országokban a lakosság 5-9 százaléka, de a 65 év feletti populációnak már közel 20 százaléka 2-es típusú cukorbeteg. A fenti időszakban a fejlődő országokban a cukorbetegek száma várhatóan 200%-kal fog növekedni.1,2
A Nemzeti Diabétesz Program adatai alapján a hazai helyzet sem jobb, miközben az ország lakóinak száma 1980-1990 között 400000-rel csökkent, a cukorbetegek száma Békés megyében megkétszereződött, Tolna megyében több mint megháromszorozódott és e megyékben a morbiditás elérte a 4,54%-ot. Miután a két megye 1983. évi nyilvántartott morbiditási adatai megegyeztek az akkori országos átlaggal, a cukorbetegek számának fenti emelkedése országos méretben is érvényesnek tekinthető. Ezek az adatforrások nem csak a cukorbetegek számának, hanem fokozott arányban a szövődmények számának emelkedéséről is beszámolnak.
A diabeteszes nephropathia kialakulása a cukorbetegek 40 százalékában várható. A betegek emiatt szoros orvosi ellenőrzést igényelnek, kiesnek a munkából, és valószínűleg ez okozza majd a halálukat is. A nephropathia diabetica a leggyakoribb oka a végstádiumú vesebetegségnek, a 90-es években a dialízisre kerülő betegek 30 százalékánál diabeteszes nephropathia állt a veseelégtelenség hátterében. Ennek sem megelőzésére, sem meggyógyítására nincs még hatásos szer.1
Bár az 1-es típusú diabeteszes betegeken a DCCT-, a 2-es típusú cukorbetegek esetében pedig a UKPDS-vizsgálat bizonyította, hogy a jó anyagcsere- (és vérnyomás-) kontroll meghosszabbítja a szövődménymentes időszakot, a már kialakult szövődmények gyógyítása, vagy a szövődmények kialakulásának megakadályozása ily módon sem érhető el. A kezelés csak a cukorbetegek életét hosszabbítja meg, de nem vezet a szövődmény gyógyulásához. Tehát minden olyan gyógyszer, amely a diabeteshez társuló veseeltérést javítani képes, vagy legalább a folyamat progresszióját leállítja, óriási jelentőségű.1,2
A BRLP-42 (bimoclomol), a BIOREX Kutató és Fejlesztő Rt. gyógyszer-várományos készítménye az állatkísérletek tanúsága szerint egy olyan vegyület, mely sikerre számíthat a cukorbetegség szövődményeinek kezelése területén. A bimoclomol nemcsak megelőzte a kísérleti állatok diabetes okozta nephro-, neuro- és retinopathiáját, de a már kialakult szövődményeket is eredményesen gyógyította.3,4,5,6 A preklinikai vizsgálatok eredménye alapján a molekula licencét az amerikai Abbott (Chicago) gyógyszergyár megvásárolta és a fázis III klinikai vizsgálatokat már ők fogják elvégezni.
A bimoclomol itt közölt, első klinikai alkalmazása során (fázis II/a vizsgálat) nemcsak a szer biztonságosságát, tolerálhatóságát, de hatásosságát is vizsgáltuk. A 24 hetes kezelés hatását a vizelettel 24 óra alatt ürített albumin mennyiségének változásán mértük le, microalbuminuriás (albuminürítés 30-300 mg/24 óra) cukorbetegeken. A vizsgálat elsődleges hatásossági mutatója az albuminuria mértékének változása volt, amely könnyen monitorozható és az albuminürítés fontos paramétere, s a cardiovascularis szövődmények vonatkozásában prediktív értéke van.
Betegek és a vizsgálati terv
A vizsgálat az Országos Gyógyszerészeti Intézet és az angliai MCA (Medicine Controll Agency) által engedélyezett multicentrikus, duplavak, randomizált vizsgálat volt, amelybe 13 magyarországi és 3 angliai diabetesközpontban gondozott 150 cukorbetegeket vontunk be: a betegek 18-70 év közötti jó anyagcsere-állapotban lévő (HbA1c<10%) 1-es és 2-es típusú férfi és a postmenopausa időszakában lévő, vagy sterilizált diabeteszes nőbetegek voltak. (Miután jelenlegi ismereteink szerint a cukorbetegség szövődményei azonos patomechanizmus alapján alakulnak ki a cukorbetegség minden típusában, a vizsgálati szer potenciális célcsoportját az "összes" cukorbeteg jelenti, és így mind az 1-es, mind a 2-es típusú cukorbeteg bekerülhetett a vizsgálatba. ) Az 1-es és a 2-es cukorbetegek 1: 10 bekerülési aránya nagyjából tükrözte a két típus európai előfordulási arányát. A beválasztás feltétele volt, hogy a 4 hetes szűrési periódusban a 3 alkalommal végzett vizeletvizsgálat során az albuminuria mértéke 30-300 mg/24 óra között legyen. A cukorbetegség kezelésének módja nem jelentett megkötést a beválasztás során. Miután a vizsgálat idején Európában nem volt forgalomban az albuminuriát bizonyítottan csökkentő orális antidiabetikum, ennek a fázis II vizsgálatnak nem volt feladata az ilyen irányú gyógyszerinterakciók vizsgálata.
Normotensiv, vagy olyan kezelt hypertoniás betegek kerülhettek a vizsgálatba, akiknek az alkalmazott kezelés mellett vérnyomása Ł160/90 Hgmm volt, és a vérnyomáscsökkentő kezelés a vizsgálat kezdetét megelőző 6 hónapban nem változott.
Jelentősen beszűkült vesefunkciójú betegek, (se-creatinin >200 mmol/l vagy 2,25 mg/dl) nem kerülhettek beválasztásra. A vizsgálati szer 40 mg BRLP-42-t (bimoclomol) vagy placebót tartalmazó kapszula volt, amelyből a betegek 24 héten át napi 3x1 darabot kaptak, étkezés előtt. A vizsgálati szert kapó csoport véletlenszerűen lett kiválasztva, megtartva az 1:1 arányt a szert és a placebót kapók között.
A vizsgálat során a betegek tovább kapták addig szedett gyógyszereiket, ACE-gátló kezelést a vizsgálat során nem lehetett elkezdeni.
A laboratóriumi paramétereket a vizsgáló centrumok mérték, kivéve Magyarországot, ahol a HbA1c-t (BIO-RAD, DIAMATT) és a vizelet albumintartalmának (Boehringer Elisa), illetve az albumin/creatinin hányadosnak a meghatározását a Veszprém Megyei Csolnoky Ferenc kórház központi laboratóriuma (Dr. Daróczy Attila) végezte.
Statisztikai értékelés
A kezelés hatékonyságát jelző 24 órás albuminürítési értékek rendkívül nagy szóródása, valamint nem-normális eloszlása miatt logaritmikus transzformációt követően végeztük az értékelést. A kiindulási értéket a négy, kezelés előtti ürítés adatából (három a "screening", egy a "baseline"), átlagolással nyertük. A változás jellemzéséhez a kiindulási értéket kivontuk a későbbi vizitek során mért adatokból (kiinduláshoz viszonyított változás). Végpontként a 24. heti albuminürítés értékét használtuk. Amennyiben a 24. heti adat nem állt rendelkezésre, akkor a 20., vagy ha az is hiányzott, akkor a 16. heti viziten mért érték került felhasználásra (az utolsó megfigyelési érték felhasználásának módszere; angol rövidítéssel LOCF).
A statisztikai értékelés első lépéseként a szokásos leíró elemzéseket végeztük, az albuminürítési adatok nagy szóródása miatt mértani átlagot számoltunk. A kezelési eljárások hatásosságának összevetése varianciaanalízissel történt. Amennyiben a két csoportban az átlagos kiindulási érték jelentősen eltért, erre korrekciót végeztünk (kovariancia-analízis). A statisztikai értékeléskor, a CI95%-értékek számolásakor a SAS 6.12 programcsomag megfelelő eljárásait használtuk.
Eredmények
A vizsgálatba 150 beteg került beválasztásra, 74 beteg kapott bimoclomolt, 76 placebót. 141 beteg fejezte be a vizsgálatot, közülük 67 kapott bimoclomolt és 73 placebót.
Nem volt szignifikáns különbség a vizsgálatba bevont szert, illetve placebót kapó csoport betegeinek átlagéletkorát (54,1+/-10,1 év, 22-71 éves tartomány, vs. 53,6+/-11,0 év, 22-70 éves tartomány), nemek szerinti megoszlását (férfi/nő arány 73/27%, vs. 79/21%), súlyát (84,4+/-14,9 vs. 84,3+/-14,0 kg), magasságát (172,0+/-8,4 vs. 171,0+/-8,3 cm) vagy a BMI-t (28,6+/-2,1 vs. 28,7+/-2,0 kg/m2) tekintve. A hat hónapos kezelési periódus alatt nem változott a betegek testsúlya, vérnyomása, klinikailag és statisztikailag jelentősen a lipid-, a vércukor-, a HbA1c-értékek, vagy az alább nem említett laborparaméterek.
A bimoclomol csoportban a vizelettel történő 24 órás albuminürítés (MAU) mértani átlaga a vizsgálat kezdetekor 80,0 mg/24 óra (CI95%: 69,1-92,5) volt, ami a 24-ik hétre 74,0 mg/24 óra (CI95%: 55,5-98,7) értékre csökkent. A kezelés időszakára számított átlagos albuminürítés 72,7 mg/24 óra (a mértani átlag a görbe alatti területből számítva). A placebo csoportban a MAU kiindulási értéke 85,0 mg/24 óra (CI95%: 72,6-99,6), amely a kezelési periódus végére 92,5 mg/24 óra (CI95%: 73,8-115,9) értékre emelkedett, a számított görbe alatti terület 81,1 mg/24 óra (CI95%: 67,4-97,6).
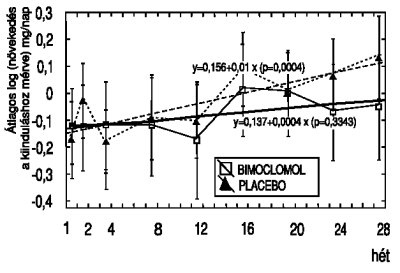
Az adatok elemzése azt mutatta, hogy a vizsgálat idején a placebo csoportban az albuminuria romlott. A 1. ábrán látható vonal illesztése mutatja, hogy a placebo csoportban a progresszió kb. heti 1%-os volt, és a 28. héten mért változás 12,1%, míg a kezelt csoportban a heti 0,4%-os változás mellett ez az érték csupán 6,7%-t ért el.
Tekintve, hogy egy nagy esetszámú dán vizsgálat7 során abban a betegcsoportban, ahol a proteinuria 150 mg/24 óra érték fölött volt, a mortalitás 10 év alatt extrém értékben növekedett és meghaladta a 70 százalékot is, a betegeket az albuminuria mértéke alapján egy enyhébb és egy súlyosabb csoportba osztottuk, ahol a határt 150 mg/24 óra albuminürítésnél húztuk meg. A kiegészítő analízisből kitűnt, hogy az enyhébb csoportban (albuminura <150 mg/24 óra) a folyamat progressziója nemcsak leállt, de a vesekárosodás javulására következtethetünk, hiszen az albuminürítés mértéke statisztikailag is szignifikánsan csökkent. Az adatok további analízise, amikor az ürített albumin mennyiségét figyelve, lépésről lépésre történt az analízis, azt mutatta, hogy a 170 mg/24 óra albuminürítésnél volt az a pont, ahol a BRLP-42-kezelés hatására már javulás nem jelentkezett ("point of no return").

1. ábra. Átlagos log-albumin ürítés növekedése (x. vizit mínusz kiindulási érték) a kezelés során
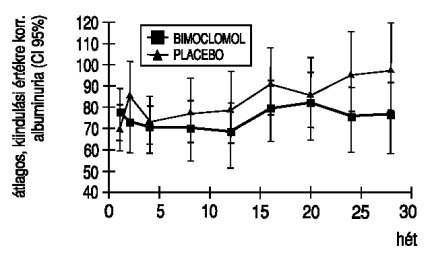
2. ábra. Az átlagos, kiindulási értékre korrigált albuminürítés változása az összes betegre
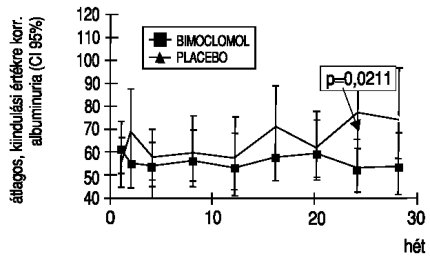
3. ábra. Az átlagos, kiindulási értékre korrigált albuminürítés változása a 150 mg/24 óra albumint ürítő betegek alcsoportjára
A betegenként ismételten mért, logtranszformált albuminuria adatokra elvégzett, a kiindulási értékek eltéréseit kiküszöbölő ismétléses varianciaanalízis a két kezelés között nem mutatott statisztikailag szignifikáns különbséget, bár leszámítva az első vizitet, minden alkalommal alacsonyabb volt a bimoclomol csoportban (2. ábra). Ugyanakkor, ha az elemzést csupán a 150 mg/24 óránál alacsonyabb albuminürítésű betegek csoportjára végezzük el, akkor a 24. hétre statisztikailag szignifikáns eltérést mutathatunk ki (3. ábra).
Bizonyos elméleti megfontolások, valamint a fenti eredmények alapján feltételezhető, hogy a bimoclomol-kezelés hatása csak hosszabb idő elteltével, lassan alakul ki, emiatt az ismétléses varianciaanalízis modell helyett egy alkalmasabbnak vélt, ún. végpontelemzést végeztünk. Az elemzést az összes betegre, illetve az enyhébb vesekárosodást mutató, kevesebb mint 150 mg/24 óra albuminürítésű csoportra is elvégeztük. A teljes csoportra nyert eredmények szerint a bimoclomol a placebo-kezeléssel szemben nem csökkenti szignifikánsan az albuminürítést (a kiindulási értékre korrigált átlagok: 74,0 mg/24 óra; CI95%: 61,5-89,1 vs. 88,6 mg/24 óra; 74,1-106,0; p=0,1734). Az enyhébb csoportban (albuminura <150 mg/24 óra) ugyanakkor a 24. hétre statisztikailag is szignifikánsan (p=0,0211) kisebb albuminürítés volt kimutatható a bimoclomol csoportban (50,9 mg/24 óra; CI95%: 41,8-62,0 vs. 70,7 mg/24 óra; 57,7-86,7; p=0,0211).
Mellékhatások
A bimoclomol-kezelés biztonságosnak bizonyult. Egy olyan súlyos mellékhatást (SAE: serious adverse event) észleltek, amelynél felmerül az esetleges összefüggés a gyógyszer szedésével. Feltételezték, hogy a kezelt csoportban az egyik beteg trauma okozta csípőtáji haematomája a gyógyszerszedés miatt növekedett.
A vizsgálat során jelentett 299 nem kívánt esemény (AE: adverse event) közül 23-at ítéltek úgy, hogy megjelenésük talán a kezeléssel összefüggött ("possible related"). A kód feltörését követően ezek közül 11 tartozott a bimoclomol-t szedők közé (egy-egy beteg esetében: flatulencia, fejfájás, szédülés, dyspepsia, haematoma, hyperlipidaemia, bőrviszketés, májenzim-emelkedés, mellkasi infekció, nyugtalanság), és 12 a placebóval kezelt betegek közé.
A kezelt csoportban négy (májenzim-emelkedés,
húgysavszint-növekedés, enyhe gamma-GT-emelkedés, hyperlipidaemia), a placebót kapók között három (creatinin-, triglycerid-emelkedés, az albuminuria romlása) olyan laboratóriumi eltérés volt, melyet AE-ként jelentettek. A normálérték háromszorosát elérő, de a következő vizitig spontán regrediáló májenzim-emelkedés miatt a kezelést nem függesztették fel. A mindegyik laboratórium paraméter vonatkozásában elvégzett Cochran-Mantel-Haenszel-féle c2 teszt egy esetben sem mutatott szignifikáns eltérést a két csoport között.
Megbeszélés
A bimoclomol hatásmechanizmusát tekintve új, a gyógyszerkutatásban, illetve gyógyszeres terápiában eddig ismert hatásmechanizmusoktól eltérő, ún. stresszfehérje (hősokkfehérje vagy heat shock protein, nemzetközi rövidítése: HSP) -koindukáló molekula. Ez azt jelenti, hogy stressz helyzetekben (hő-, mechanikai-, metabolikus, oxidatív stressz stb.) fokozza a sejtekben képződő chaperonok vagy dajka fehérjék családjába tartozó stresszfehérjék szintézisét.7,8
A stresszfehérjéknek alapvető szerepük van a sejtek életében, felelősek az újonnan szintetizált peptidek összeszereléséért, térbeli szerkezetükért, a sejten belüli membránokon történő áthaladásért, a membránok épségéért, a hibás fehérjék felismeréséért és lebontásáért, hogy csak a legismertebbeket említsük.9,10 Érthető tehát, hogy ezek a fontos fehérjék minden sejtben megtalálhatók, a fajfejlődés során alig változtak. Szerepük a sejtek normális működésének fenntartásában, a betegségek elleni védekezésben még kevéssé ismert, de biztosan alapvető.
A hősokkfehérjék molekulatömege 10 és 150 kDa között változik, ezt használják megkülönböztetésükre, ezt tükrözi nevük is (HSP-150, HSP-90, HSP-70, HSP-60 stb. molekulacsalád), de úgy tűnik, hogy a különböző molekulatömegű csoportok feladata eltérő, és jellemző az adott csoportra. HSP-t találunk minden főbb sejtkompartmentben, ismerjük konstitutív és indukálható formájukat. A HSP-70 konstitutív formája nyugalmi helyzetben is jelentős mennyiségben expresszálódik minden sejtben, stressz hatásra az induktív forma, a HSP-72 expressziója emelkedik meg.9,10
Az intracelluláris HSP-szint emelése (pl. transzgénikus állatokban a gén fokozott expressziójakor, vagy előzetes stressz-, illetve hőkezelés hatására) "kondicionálja" a sejteket, és így az egyébként halálos mértékű stressz túlélése lehetővé válik.11,12,13,14,15 A HSP-rendszer károsodása a stresszel szembeni tűrőképességet csökkenti, és pl. a BB patkányokban diabetes kialakulására hajlamosít,16 vagy késlelteti a sebgyógyulást.17
Ma még csak feltételezéseink vannak arról, hogy mi a HSP-k szerepe a cukorbetegség és szövődményeinek kialakulásában. Az a tény, hogy a 2-es típusú cukorbetegek izomszövetében a normálisnál nagyságrenddel alacsonyabb a HSP-72 gén expressziója18,19 (ez a jelenség a cukorbetegség-várományos egypetéjű ikerpár még nem cukorbeteg tagjában is észlelhető, tehát a kóros anyagcserehatások megjelenése előtt) és 2-es típusú cukorbetegek mononukleáris sejtjeiben a HSP-72 gén hővel alig20 indukálható, arra utalhat, hogy a HSP-gén meghatározó szerepet játszhat az állandó anyagcsere-stressznek kitett cukorbeteg sejtek életében.
A peroxisomákban végbemenő b-oxidáció és a peroxisoma proliferátorok által aktivált receptorok (PPAR) szerepe az anyagcserében, sejtproliferációban és az endothel funkciókban az elmúlt évek nagy felfedezése. A PPAR nukleáris receptor család a folyamatokban részt vevő gének átírásának gátlásával vagy fokozásával aktiválja és szabályozza a zsírsejtek fejlődését, a lipidanyagcserét, a ketogenesist, a szabad zsírsavak szintézisét, a lipoprotein-metabolizmust,21 és ezen keresztül a cukoranyagcsere egyensúlyát. Ezek a receptorok antiatherogen hatásúak,22 és ezeken hat az inzulin hatását fokozó glitazon molekulacsalád.23 A HSP számos funkciója mellett peroxisoma proliferator kötő fehérje,24 a cytosolban elhelyezkedő HSP-72 chaperon hatása szükséges a PPAR aktiválásához.25 Tehát amíg a tiazolidindionok a PPAR-rendszer agonistái és a PPAR-gének átírását fokozzák, addig a HSP gén koindukátorok a rendelkezésre álló HSP-72 mennyiségét növelik és így a PPAR-receptorral komplexet képezve azt stabilizálják, és annak funkcióját biztosítják.
Míg a nagy molekulájú HSP90 az endotheliais NO-szintázhoz (iNOS) kapcsolódva hozzáférhetővé teszi azt az agonisták számára és így fokozza az enzim hatását és az NO termelését,26 valamint részt vesz az erek tónusának szabályozásában,27 addig a kis molekulájú HSP27-nek a endothelialis sejtek migrációja szabályozásában van szerepe28
Előzetes vizsgálataink szerint a bimoclomol hatására a sejtek képesek a betegség okozta szerkezeti károsodások (membránfehérjék, enzimek stb.) kijavítására és így a gyógyulásra, illetve nő az ellenálló képességük a különböző stressz-tényezőkkel szemben. A bimoclomol HSP-produkciót fokozó hatását széles körben, különböző állatfajokból származó, különböző szerveken és kultúrában tartott sejteken is kimutattuk. A stressz szignál hatását - függetlenül annak természetétől (hő, kémiai stressz, növekedési faktor megvonása, TNF-á stb.) - fokozta az izolált szervekben és in vivo állatmodellekben is. A sejtek stresszfehérje szintjének mérhető emelkedése jól korrelált a farmakológiai hatással, akár a myocardium necrosis mértékét vizsgálták a coronaria occlusio/reperfusio során, vagy az endothelfunkciók és morfológia javulását krónikus kezelések után, vagy az egerekbe átültetett humán bőrmintában az UV-sugárzás károsító hatását.6
A klinikai tanulmány elsődleges célja az volt, hogy a bimoclomol biztonságosságát és tolerálhatóságát vizsgáljuk, ezért a vizsgált populáció kevert volt, minkét típusú cukorbeteg és neuro- vagy retinopathia szempontjából a tünetmentes és súlyosabb tünetekkel rendelkező betegek egyaránt előfordultak a csoportokban. A vizsgálat jellege miatt csak hat hónapos kezelésre és csak egy dózis adására kerülhetett sor, így a vizsgálat arra nem tud választ adni, hogy humán vonatkozásban a megfelelő dózissal dolgoztunk-e, illetve, hogy a cukorbetegség krónikus szövődményeinek kezelésekor a hat hónapos terápia elegendő volt-e.
A bimoclomol (BRLP-42) biztonságos, jól tolerálható szernek bizonyult, néhány mellékhatást (AE) észleltek mindössze, melyek összefüggése a gyógyszer adásával nem volt bizonyítható.
A hat hónapos klinikai vizsgálat során az albuminuria és a hátterében álló diabeteszes nephropathia progresszióját a BRLP-42 kezelés megállította. Ez a trend a hatodik hónap végére erősen (p=0,0004) szignifikáns lett. Az albuminuria mértéke szerint kettéosztott betegpopuláció (albuminuria kisebb, illetve nagyobb mint 150 mg/24 óra) adatai azt mutatták, hogy az időben kezdett kezelés, amikor a kórfolyamat még kevés visszafordíthatatlan morfológiai elváltozással társult, nemcsak leállítja a folyamat progresszióját, de javulást is képes elérni.
A bimoclomol a HSP-gén expresszióját koindukáló hatásmechanizmusának ismeretében feltételezhető, hogy a megnövekedett mennyiségű, az indukálható iNOS enzimmel komplexet képező, annak aktivitásához szükséges HSP csak akkor lehet hatásos, amikor a vese ereinek eltérése még olyan stádiumban van, amikor a megemelkedett iNOS aktivitás "célpontja", az endothel, még nem károsodott visszafordíthatatlanul. Saját adataink alapján, legalábbis a BRLP-42 kezelés és az albuminuria esetében 170 mg/24 órás érték körül találtuk azt a határt, ahonnan talán már nincs visszatérés.
Összefoglalóan az új hatásmechanizmusú, az intracelluláris hősokkfehérje szintjét emelő bimoclomol ígéretes szernek bizonyul a cukorbetegséghez társuló veseszövődmények kezelésére, mert a hat hónapos klinikai kezelés során megállította a diabeteszes albuminuria progresszióját. Igazi értékét a megfelelő humán dózis keresését biztosító további fázis II vizsgálat után, majd a nagyszámú beteggel végzett fázis III klinikai tanulmány fogja eldönteni. Addig hátra van még a hatásmechanizmus részletesebb feltárása, ami nemcsak a bimoclomol szempontjából fontos, de a stresszfehérjék szerepének vizsgálata a diabetes és szövődményeinek kialakulásában teljesen új területe a cukorbetegséggel foglalkozó kutatásnak.
A BRLP-42 vizsgálat centrumainak munkatársai
Dr. John K. Wales (Martin Wing, The General Infirmary, Leeds, Anglia); Dr. RJM Corrall (Directorate of Medicine, Bristol Royal Infirmary, Bristol, Anglia); Dr. John Harvey (Diabetes and Renal Unit, Wrexham Maelor Hospital, Wrexham, Anglia); Prof. dr. de Châtel Rudolf (SOTE I. sz. Belgyógyászati Klinika, Budapest); Dr. Somogyi Anikó (SOTE II. sz. Belgyógyászati Klinika, Budapest); Dr. Pánczél Pál (SOTE III. sz. Belgyógyászati Klinika, Budapest); Prof. dr. Pogátsa Gábor (Országos Kardiológiai Intézet, Budapest); Prof. dr. Halmos Tamás (Országos Korányi TBC- és Pulmonológiai Intézet, Budapest); Porf. dr. Kammerer László (Szent István Kórház, Budapest); Dr. Fövényi József (Péterfy Sándor utcai Kórház, Budapest); Prof. dr. Jermendy György (Bajcsy-Zsilinszky Kórház-Rendelőintézet, Budapest); Dr. Dömötör Erzsébet (MÁV Központi Rendelőintézet, Budapest); Prof. dr. Simon Kornél (Szent György Kórház, Székesfehérvár); Dr. Vándorfi Győző (Veszprém Megyei Csolnoky Ferenc Kórház, Veszprém); Dr. Tárnok Ferenc (Zala Megyei Kórház, Zalaegerszeg); Dr. Hídvégi Tibor (Petz Aladár Megyei Kórház, Győr).
IRODALOM
1. Fleming, GA, Jee, SS, Coniff, RF: Optimizing therapeutic development in diabetes. Oxford University Press. 1999. pp. 3-15.
2. Clark, CM, Lee, DA: Prevention and treatment of the complications of diabetes mellitus. N Engl J Med 332: 1210-1217, 1995.
3. Biro K, Jednakovits A, Kukorelli T, Hegedus E, Koranyi L: Bimoclomol (BRLP-42) ameliorates peripheral neuropathy in streptozotocin-induced diabetic rats. Brain Res Bull 44: 259-263, 1997.
4. Biro K, Palhalmi J, Toth AJ, Kukorelli T, Juhasz G: Bimoclomol improves early electrophysiological signs of retinopathy in diabetic rats. Neuro Report 9: 2029-2033, 1998.
5. Jaszlits L, Jednakovits A, Koltai M: Anti-ischemic efficacy of BRLP-42. J Mol Cell Cardiol 25 (Suppl. I): XI. P 20. 1993.
6. Vigh L, Literáti PN, Horváth I, Török Z, Balogh,G, Glatz A, Kovács E, Boros I, Ferdinándy P, Farkas B, Jaszlits L, Jednákovits A, Korányi L, Maresca, B: Bimoclomol: a nontoxic, hydroxylamine derivative with stress proteininducing activity and cytoprotective effects. Nature Med 3: 1150-1154, 1997.
7. Poulsen, L, Hansen, KW, Mogensen, CE: Ambulatory blood pressure in the transition from normo- to microalbuminuria. Diabetes 43: 1248-1253, 1994.
8. Jednakovits A, Kurucz I, Hegedüs E, Koranyi L: Protection of endothelium by bimoclomol (Increased expression of heat shock, HSP-72 gene). Diabetologia 40 (Suppl. 1): 1585, (A 403) 1997.
9. Gething, MJ, Sambrook, J: Protein folding in the cell. Nature 355: 33-45, 1992.
10. Hartl, FU: Molecular chaperones in cellular protein folding. Nature 381: 571-579, 1996.
11. Marber, MS, Mestril, R, Chi, S-H, Sayner, MR, Yellon, DM, Dillmann, WH: Overexpression of the rat inducible 70 kD heat stress protein in a transgenic mouse increases the resistance of the heart to ischemic injury. J Clin Invest 95: 1446-1456, 1995.
12. Benjamin, IJ, McMillan, DR: Stress (heat shock) proteins: molecular chaperones in cardiovascular biology and disease. Circ Res 83: 117-132, 1998.
13. Ribeiro, SP, Villar, J, Slutsky, AS: Induction of the stress response to prevent organ injury. New Horiz 3: 300-311, 1995.
14. Plumier, JC, Ross, BM, Currie, RW: Transgenic mice expressing the human heat shock protein 70 have improved post-ischemic myocardial recovery. J Clin Invest 95: 1845-1860, 1995.
15. Hutter, JJ, Mestril, R, Tam, EK, Sievers, RE, Dillmann, WH, Wolfe, CL: Overexpression of heat shock protein 72 in transgenic mice decreases infarct size in vivo. Circulation 9: 1408-1411, 1996.
16. Bellmann, K, Hui, L, Radons, J, Burkart, V, Kolb, H: Low stress response enhances vulnerability of islets cells in diabetes-prone BB rats. Diabetes 46: 232-236, 1997.
17. Bitar, MS, Farook, T, John, B, Francis, IM: Heat shock protein 72/73 and impaired wound healing in diabetic and hypercortisolemic states. Surgery 125: 594-601, 1999.
18. Korányi L, Groop, L, Kurucz I: Csökkent hő-shock gén expresszió II-es típusú cukorbetegek izomszövetében. Magyar Belorvosi Arch 49 (Suppl. 2): 169, 1996.
19. Kurucz I, Morva, A, Vaag, A, Eriksson, K-F, Huang, X, Groop, L, Koranyi L: Decreased expression of heat shock protein (HSP-72) in skeletal muscle of monozygotic twins discordant for diabetes, correlates with glucose uptake. Diabetes, Megjelenés alatt.
20. Hegedűs E, Kurucz I, Morva, A, Vaag, A, Eriksson, K-F, Lehtovirta, M, Huang, X, Groop, L, Koranyi L: Alteration of HSP72i gene expression and function in NIDDM. Diabetologia 41 (Suppl. 1.): A114 (445) 1998.
21. Latruffe, N, Vamecq, J: Peroxosome proliferators and peroxisome proliferator activated receptors (PPARs) as regulator of lipid metabolism. Biochemie 79: 81-94, 1997.
22. Li, AC, Brown, KK, Silvestre, MJ, Willson, TM, Palinski, W, Glass, CK: Peroxisome proliferator-activated receptor g ligands inhibit development of atherosclerosis in LDL receptor-deficient mice. J Clin Invest 106: 523-531, 2000.
23. Nolan, JJ, Kudvik, B, Beersen, P, Joyce, M, Olefsky, J: Improvement in glucose tolerance and insulin resistance in obese subjects treated with troglitazone. N Engl J Med 331: 1188-1193, 1994.
24. Alvares, K, Alejandro, C, Yuan, PM, Kawano, H, Morimoto, RI, Reddy, JK: Identification of cytosolic preoxisome proliferator binding protein as a member of the heat shock protein HSP-70-family. Proc Natl Acad Sci USA 87: 5293-5297, 1990.
25. Huang, G, Alvares, K, Chu, R, Bradfield, CA, Reddy, JK: Association of the peroxisome proliferator-activated receptor and HSP72. J Biol Chem 269: 8493-8497, 1994.
26. Garcia-Cardena, G, Fan, R, Shah, V, Sorrentino, R, Cirino, G, Papapetropoulus, A, Sessa, WC: Dynamic activation of endothelial nitric oxide synthase by HSP90. Nature 392: 821-823, 1998.
27. Russel, KS, Haynes, MP, Caulin-Glaser, T, Rosneck, J, Sessa, WC, Bender, JR: Estrogen stimulates heat shock protein 90 binding to endothelial nitric oxide synthase in human vascular endothelial cells. J Biol Chem 275: 5026-5030, 2000.
28. Shah, V, Wiest, R, Garcia-Cardena, G, Cadelina, G, Groszmann, RJ, Sessa, WC: HSP90 regulation of endothelial nitric oxide synthase contributes to vascular control in portal hypertension. Am J Physiol 277: G463-468, 1999.
29. Piotrowitcz, RS, Hickey, E, Levin, EG: Heat shock protein 27 kDa expression and phospholylation regulates endothelial cell migration. FASEB J 12: 1481-1490, 1998.
- A szerző levelezési címe: Dr. Korányi László,
- DRC, Gyógyszervizsgáló Központ
- 8231 Balatonfüred, Pf. 85.