Petz Aladár Megyei Oktató Kórház, IV. Belgyógyászati Osztály1 és Központi Laboratórium,2 Győr; Országos Élelmezés- és Táplálkozástudományi Intézet,3 Bajcsy-Zsilinszky Kórház, III. Belgyógyászati Osztály,4 Budapest
METABOLIKUS SZINDRÓMA SZŰRÉSÉNEK TAPASZTALATAI GYŐR VÁROSÁBAN ÉS VONZÁSKÖRZETÉBEN
Hidvégi Tibor dr.,1 Hetyési Katalin dr.,2 Bíró Lajos dr.,3 Jermendy György dr.4
Összefoglalás
A szerzők Győr városában és vonzáskörzetében háziorvosok bevonásával szűrővizsgálatot végeztek olyan 20-65 év közötti egyének között, akik a szűrési kritériumok (kóros BMI [>30,0 kg/m2]; nagyobb derék-csípő hányados [férfiak: >0,90; nők: >0,85]; újonnan felismert vagy korábbról kezelt hypertonia [RR: >=140/90 Hgmm]) legalább egyikével rendelkeztek. A szűrésen részt vett egyének családi anamnézisét (diabetes, hypertonia, elhízás, korai cardiovascularis esemény előfordulása) rögzítették. Ismert cukorbeteg nem szerepelt a vizsgálatban. A szűrésen megjelentek (n=1041) antropometriai és klinikai vizsgálata után laboratóriumi adatokat határoztak meg éhomi vérvétel, illetve orális glukóztolerancia-teszt (75 g glukóz, 120 perces érték mérése) során. Az inzulinrezisztencia mértékét az éhomi és postprandialis plazma inzulin érték mérésén túlmenően a HOMA (homeostasis model assessment) meghatározásával is jellemezték. Az értékelhető adatokkal rendelkező 944 szűrt egyén (545 nő, 399 férfi; életkor 46,1+/-7,3 év; BMI 32,2+/-5,4 kg/m2; derék-csípő hányados 0,90+/-0,09; x+/-SD) 52,9%-ában hyperinsulinaemia (éhomi inzulinszint >15 mU/ml és/vagy terhelési után >45 mU/ml) volt megállapítható. A szűréssel a metabolikus szindróma kórfejlődésének korai stádiuma (hyperinsulinaemia normális glukóztoleranciával) volt nagyobb arányban (33,2%) felismerhető, a későbbi stádiumok (hyperinsulinaemia csökkent glukóztoleranciával, illetve hyperinsulinaemia diabetesszel) kisebb arányban (13,0%, illetve 6,7%) fordultak elő. A vizsgált kohorsz 23,6%-ában a glukóz-intolerancia valamely fokát lehetett megállapítani. A szűrésen részt vettek 93,6%-ánál volt a családi anamnézis terhelő. A kóros klinikai jelek egyedüli jelenlétekor a hyperinsulinaemia előfordulási aránya kóros BMI esetén volt a legnagyobb (56,8%), ezt követte a kóros derék-csípő hányados jelenlétekor észlelt arány (43,8%), s a legalacsonyabb előfordulási arány (27,1%) hypertonia esetén volt észlelhető. A metabolikus szindróma kórisméje a vizsgált csoport 31,5%-ában volt megállapítható, a férfiak érintettsége (36,6%) számottevően (p<0,01) nagyobb volt, mint a nőké (27,7%). A metabolikus szindrómában szenvedő egyének időben történő regisztrálása a primer prevenció alapját teremtheti meg - az érintett egyének azonosításában a legegyszerűbben vizsgálható klinikai paraméterek (vérnyomás, BMI, derék-csípő hányados) hasznos segítséget nyújtanak. Az inzulinrezisztencia (hyperinsulinaemia) felismerésében az elhízásnak (kóros BMI, illetve kóros derék-csípő hányados) nagyobb szerepe van, mint a hypertonia jelenlétének. Több kóros klinikai jel együttes jelenléte az inzulinrezisztencia (hyperinsulinaemia) növekvő arányú előfordulásával jár együtt.
Kulcsszavak: Metabolikus szindróma, inzulinrezisztencia, hyperinsulinaemia, 2-es típusú diabetes, obesitas, hypertonia, dyslipidaemia, orális glukóztolerancia-teszt
Screening for metabolic syndrome in Győr and in its neighbourhood
Summary
In order to detect subjects with metabolic syndrome, a mass-screening was performed in Győr and in its neighbourhood. Subjects of both sexes aged from 20 to 65 years exhibited at least one of the following clinical characteristics: hypertension (subjects with antihypertensive treatment or actual blood pressure >=140/90 mmHg), abnormal (>30.0 kg/m2) BMI or elevated waist-hip ratio (>0.85 in women, >0.90 in men). The family history (diabetes, hypertension, obesity, early cardiovascular events) of each patient was recorded. Patients with diabetes mellitus in the past medical history were not involved. At screening (n=1041), anthropometric and physical investigations were performed followed by an oral glucose tolerance test with 75 g glucose. Insulin resistance was characterised by fasting and postprandial plasma insulin values as well as by HOMA (homeostasis model assessment). In subjects available for analysis (n=944; women/men: 545/399; age: 46.1+/-7.3 years; BMI 32.2+/-5.4 kg/m2; waist-hip ratio 0.90+/-0.09; x+/-SD) hyperinsulinaemia (serum fasting insulin >15 mU/ml and/or postload [120 min after 75 g OGTT] insulin >45 mU/ml) was detected in 52.9%. Early stage of metabolic syndrome (hyperinsulinaemia with normal glucose tolerance) was more often (33.2%) detected while later stages (hyperinsulinaemia with IGT or diabetes) were in a lower proportion (13.0% and 6.7%, respectively) found in subjects screened. Glucose intolerance (IGT or diabetes mellitus) could be found in 23.6% of subjects. Positive family history was documented in 93.6% of the total cohort. When abnormal clinical signs were separately analysed, hyperinsulinaemia was found in 56.8% of subjects with abnormal BMI, in 43.8% of subjects with abnormal waist-hip ratio, and in 27.1% of subjects with hypertension. Metabolic syndrome was diagnosed in 31.5% of subjects with a male predominance (men: 36.6%; women: 27.7%; p<0.01). Primary prevention could be based on the results of a screening procedure. To identify subjects at risk of metabolic syndrome, routine clinical investigations (measuring blood pressure, BMI and waist-hip ratio) are simple but useful. Obesity (abnormal BMI; abnormal waist-hip ratio) is of greater importance than hypertension alone for identifying subjects with insulin resistance (hyperinsulinaemia). Clustering of abnormal clinical characteristics coexist with higher proportion of hyperinsulinaemia in subjects at risk of metabolic syndrome.
Key words: Metabolic syndrome, insulin resistance, hyperinsulinaemia, type 2 diabetes, obesity, hypertension, dyslipidaemia, oral glucose tolerance test
Rövidítésjegyzék: BMI: testtömeg-index (body mass index), HOMA: homeostasis model assessment, IGT: csökkent glukóztolerancia (impaired glucose tolerance), NGT: normális glukóztolerancia, OGTT: oralis glukóztolerancia teszt, WHO: Egészségügyi Világszervezet
A 2-es típusú cukorbetegség kialakulását a metabolikus szindróma koncepciója több mint egy évtizeddel ezelőtt új megvilágításba helyezte.1 A napjainkban már széles körben elfogadott elmélet szerint a több évre elnyúló kórfejlődés, a glukózintolerancia kialakulásának hátterében inzulinrezisztencia és következményes hyperinsulinismus húzódik meg. A hyperinsulinismus nemcsak a metabolikus szindróma egyes további jellegzetességeit magyarázza, hanem a tartós hyperinsulinaemia az akcelerált atherosclerosis kialakulásának patomechanizmusában is szerepet kap.2,3,4,5 Ez utóbbi mellett számos kísérletes adat szól,6 de többéves, olykor egy-két évtizedig végzett prospektív klinikai vizsgálatok eredményei is igazolták, hogy a plazma inzulinszintje (éhomi és/vagy postprandialis érték) a később bekövetkező coronaria-események vonatkozásában egyértelmű prediktív értékkel rendelkezik,7,8
A 2-es típusú diabetes népegészségügyi jelentősége közismert. A jelenlegi prevalencia-adatok és a várható incidencia-növekedés alapján a 2-es típusú cukorbetegség komoly kihívást jelent az egészségügy valamennyi szereplője számára.9 Ez különösen igaz, ha figyelembe vesszük az e diabetes-típusra jellemző macroangiopathiás szövődmények gyakoriságát, illetve az érintett egyének ellátásának nehézségeit. A cardiovascularis megbetegedések kockázatnövekedése terén azonban nemcsak a manifeszt diabetes, hanem az IGT is hangsúlyos szerepet kap.10 Mindezek miatt a 2-es típusú diabetes primer prevenciója, a macroangiopathiás szövődményekben még nem szenvedő egyének időben történő felismerése nagy jelentőségű.
Tanulmányunkban azt vizsgáltuk, hogy klinikai gyanújelek alapján veszélyeztetett egyének között milyen gyakorisággal számíthatunk hyperinsulinaemia (inzulinrezisztencia) előfordulására, illetve milyen arányúak ezen egyének körében a glukóz-intolerancia különböző stádiumai. A nagyszámú egyént érintő szűrővizsgálat során adatokat gyűjtöttünk arra nézve, hogy milyen jelentősége van a metabolikus szindróma egyes klinikai jellegzetességeinek a hyperinsulinaemiás (inzulinrezisztens) egyének felismerésében.
Betegek és módszerek
Győr városának és vonzáskörzetének háziorvosaival együttműködve a metabolikus szindróma hazai jellegzetességeit megismerendő szűrővizsgálatot kezdeményeztünk. Az önkéntes alapon zajló szűrővizsgálaton 1998-tól kezdődően azok a 20-65 év közötti egyének vettek részt, akik az alábbi három klinikai ismérv közül legalább eggyel rendelkeztek: kóros BMI (>30,0 kg/m2), nagyobb derék-csípő hányados (férfiak: >0,90; nők: >0,85), újonnan felismert (RR: >=140/90 Hgmm) vagy korábbról kezelt hypertonia. A vizsgált egyének családi anamnézisét (diabetes, hypertonia, elhízás vagy korai cardiovascularis esemény előfordulását) rögzítettük. Ismert cukorbeteg nem szerepelt a vizsgálatban. A szűrővizsgálaton megjelentek antropometriai vizsgálatán (BMI és derék-csípő hányados megállapításán) túlmenően adatokat gyűjtöttünk az életmódról, a fizikai aktivitásról, az étkezési szokásokról és az iskolai végzettségről (utóbbi adatok analízisét a tanulmányunk nem tartalmazza). A vizsgálat elején (10 perc pihenést követően) és végén (az anamnézis felvétele után), ülő helyzetben a jobb és a bal felkaron vérnyomást mértünk, nyugalmi vérnyomásnak a négy mérés átlagát tekintettük. Ezt követően fizikális vizsgálatot végeztünk, majd éhomi vérvételre került sor. Az éhomi vérmintából meghatároztuk a vércukor, az inzulin, a lipidek (az össz-cholesterin, a triglycerid, a HDL-cholesterin) és a húgysav mennyiségét. Minden egyénnél 75 g glukózzal OGTT-t is végeztünk, s meghatároztuk a 120 perces vércukor- és inzulinszinteket is. A plazma inzulinszintjén túlmenően az inzulinrezisztencia mértékét a HOMA (homeostasis model assessment) (éhomi inzulin [mU/ml] x éhomi vércukor [mmol/l]/22,5) meghatározásával is jellemeztük. Hyperinsulinaemiásnak minősítettük azokat az egyéneket, akiknek éhomi inzulinszintje >15 mU/ml és/vagy 120 perces postprandialis inzulinszintje >45 mU/ml volt. Hypertoniásnak tekintettük azokat, akik a kórelőzményben szereplő hypertonia miatt antihypertensiv kezelésben részesültek, illetve ilyen előzményi adatok hiányában az aktuális vérnyomásuk >=140/90 Hgmm-nek bizonyult. Kóros BMI-t állapítottunk meg nemtől függetlenül >30,0 kg/m2 érték esetén, a derék-csípő hányados kóros értékénél a nemi különbséget figyelembe vettük (férfiak >0,90; nők >0,85). A szérum triglycerid >=1,70 mmol/l, a HDL-cholesterin <0,9 mmol/l (férfiak), illetve <1,0 mmol/l (nők) értékét tekintettük kórosnak. Az OGTT eredménye alapján a glukóz-intolerancia stádiumait (IGT, diabetes mellitus) a WHO-kritériumok szerint, a 120. perces érték alapján állapítottuk meg. A szűrővizsgálaton 1041 egyén jelent meg, a jelenlegi dolgozatban annak a 944 egyénnek az adatait dolgoztuk fel, akik esetében valamennyi klinikai és laboratóriumi adat rendelkezésre állt.
A metabolikus szindróma jelenlétét akkor állapítottuk meg, ha az alább felsorolt négy kritérium közül az első mellett legalább még bármelyik másik két kritérium is jelen volt:
1. Diabetes mellitus, vagy IGT, vagy inzulinrezisztencia (NGT mellett felső quartilisbe [>4,43] eső HOMA-érték).
2. Hypertonia (kezelt vagy újonnan felismert).
3. Dyslipidaemia (szérum triglycerid >=1,70 mmol/l vagy HDL-cholesterin <0,9 mmol/l [férfiak], illetve <1,0 mmol/l [nők]).
4. Obesitas (BMI >30 kg/m2 vagy derék-csípő hányados >0,90 [férfiak], illetve >0,85 [nők]).
A vércukrot hexokináz-módszerrel, a lipidek értékét enzimatikus módon, a húgysavat urokináz-módszerrel határoztuk meg. A plazma inzulin értékét enzim-immuno-assay-vel mértük.
A szűrővizsgálat zárása (2000. június 30.) után elvégeztük az adatok statisztikai feldolgozását, melynek során Student-féle kétmintás t-próbával és ÷2-teszttel vizsgáltuk a csoportok közötti különbségeket, illetve korreláció-analízist számoltunk. A táblázatokban az adatokat átlag+/-szórás (x+/-SD) formában tüntettük fel. A p<0,05 értéket tekintettük statisztikailag szignifikáns különbségnek.
Eredmények
A 944 vizsgált egyén (545 nő és 399 férfi) átlagos életkora 46,1+/-7,3 év, testtömeg-indexe 32,2+/-5,4 kg/m2, derék-csípő hányadosa 0,90+/-0,09 volt. A férfiak és nők életkora (45,8+/-7,4 vs. 46,3+/-7,2 év), testtömeg-indexe (32,1+/-5,0 vs. 32,2+/-5,6 kg/m2) számottevően nem tért el egymástól (p>0,05), a férfiak derék-csípő hányadosa (0,97+/-0,07) azonban szignifikánsan (p<0,001) nagyobb volt, mint a nők hasonló értéke (0,86+/-0,07). A szűrővizsgálaton részt vettek között 880 egyén (93,6%) családi anamnézise volt pozitív.
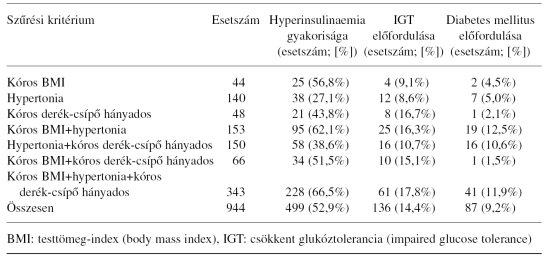
A metabolikus szindróma klinikai jelei 232 esetben önállóan voltak jelen, azok különböző kettős kombinációkban való együttes jelenlétét 369 esetben figyeltük meg, míg mindhárom klinikai jel egyszerre 343 szűrt egyénnél fordult elő (1. táblázat). A vizsgált teljes kohorszban (n=944) hyperinsulinaemiásnak bizonyult 499 (52,9%) fő. Hyperinsulinaemia legnagyobb arányban (66,5%) akkor fordult elő, ha mindhárom klinikai jel egyszerre volt jelen. A kettős előfordulási kombinációk között a hyperinsulinaemia előfordulási aránya kóros BMI+hypertonia esetén volt a legnagyobb (62,1%), ezt követte a kóros BMI+kóros derékcsípő hányados esetén észlelt arány (51,5%). A kóros klinikai jelek egyedüli jelenlétekor a hyperinsulinaemia előfordulási aránya kóros BMI esetén volt a legnagyobb (56,8%), ezt követte a kóros derék-csípő hányados (43,8%). Noha hypertonia önállóan a betegek nagyobb számában (n=140) volt kimutatható, e csoporton belül volt a hyperinsulinaemia előfordulási aránya a legkisebb (27,1%) (1. táblázat).
A vizsgált teljes kohorszban (n=944) IGT-t találtunk 136 esetben (14,4%), terheléssel diabetest lehetett megállapítani 87 esetben (9,2%), így a szűrővizsgálaton megjelentek 23,6%-ában glukóz-intolerancia volt kimutatható. Az IGT előfordulási aránya abban az alcsoportban volt a legnagyobb (17,8%), ahol mindhárom klinikai jel együtt fordult elő. Terheléssel felismert diabetest legnagyobb arányban (12,5%) a kóros BMI-vel és hypertoniával együttesen rendelkező alcsoportban találtunk (1. táblázat).
A teljes kohorszban (n=944) az egyes klinikai jelek a többi klinikai jel jelenlététől vagy hiányától függetlenül az alábbiak szerint fordultak elő: kóros BMI n=606 (64,2%), hypertonia n=786 (83,3%), kóros derék-csípő hányados n=607

1. táblázat. A hyperinsulinaemia és a glukóz-intolerancia (IGT, diabetes mellitus) relatív előfordulási gyakorisága a szűrési kritériumok alapján kóros értékkel rendelkezők között
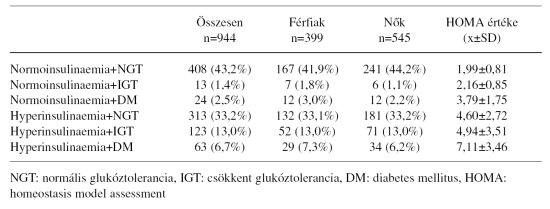
2. táblázat. A normo- és hyperinsulinaemia, illetve a glukóztolerancia stádiumainak előfordulása [esetszám (%)] a vizsgált kohorszban (n=944). A táblázat jobb oldalán az inzulinrezisztencia mértékét jelző HOMA-érték (x+/-SD) található
(64,3%), kóros BMI+hypertonia n=496 (52,5%), hypertonia+kóros derék-csípő hányados n=493 (52,2%), kóros BMI+kóros derék-csípő hányados n=409 (43,3%), kóros BMI+hypertonia+kóros derék-csípő hányados n=343 (36,3%). A hypertoniásnak bizonyult 786 egyén csoportjában a korábbról már antihypertensiv kezelésen lévők domináltak (86,1%), míg az újonnan felismert hypertoniások aránya sokkal kisebb (13,9%) volt.
A normoinsulinaemiát döntően normális glukóztolerancia kísérte (n=408, 43,2%), s csak igen kis számban fordult elő normoinsulinaemia mellett IGT (n=13, 1,4%) vagy diabetes (n=24, 2,5%). A szűrés kapcsán relatíve nagyobb számban találtunk a metabolikus szindróma korai stádiumában lévő egyént (hyperinsulinaemia normális glukóztoleranciával, n=313, 33,2%), kisebb számban fordult elő a metabolikus szindróma későbbi stádiuma (hyperinsulinaemia IGT-vel, n=123, 13,0%; hyperinsulinaemia diabetesszel, n=63, 6,7%). Érdemi nembeli különbség a megoszlási arányban nem mutatkozott (2. táblázat). A HOMA értéke nagyobb volt a hyperinsulinaemiások csoportjában, mint a normoinsulinaemiá sokéban, és a két csoporton belül a glukóztolerancia romlásával fokozatosan növekvő HOMAértéket lehetett megfigyelni (2. táblázat).
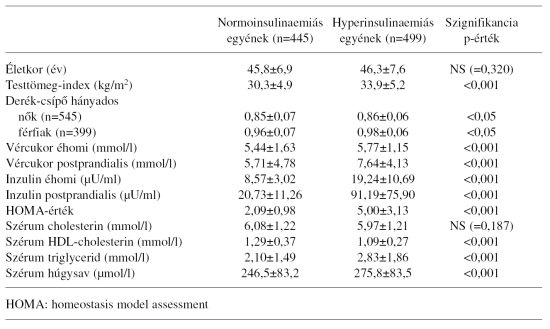
3. táblázat. A normo- és hyperinsulinaemiás egyének (n=944) fontosabb klinikai és laboratóriumi adatai (x+/-SD)
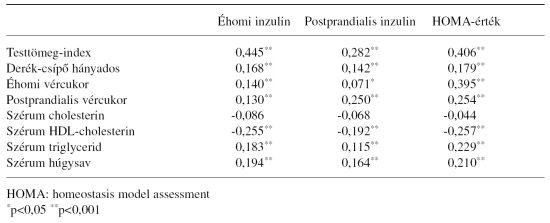
4. táblázat. A szérum inzulin szintek, a HOMA-érték és a fontosabb klinikai-laboratóriumi adatok közötti korreláció (r-érték, n=944)
A szűrővizsgálat során 499 fő (52,9%) hyperinsulinaemiásnak, 445 fő pedig (47,1%) normoinsulinaemiásnak bizonyult. A hyperinsulinaemiás egyének testtömeg-indexe, derék-csípő hányadosa, éhomi és postprandialis vércukorértéke, illetve szérum triglycerid és húgysav szintje számottevően magasabb, a HDL-cholesterin-értékük pedig szignifikánsan alacsonyabb volt, mint a normoinsulinaemiásoké. A hyper- és normoinsulinaemiás csoport szérum össz-cholesterin értéke nem különbözött érdemben egymástól (3. táblázat).
A szérum inzulin szintek, a HOMA-érték és a vizsgált egyének testtömeg-indexe, derék-csípő hányadosa, a vércukorértékek (éhomi és postprandialis), a szérum triglycerid és húgysav érték között szignifikáns pozitív korrelációt lehetett igazolni. A HDL-cholesterin a szérum inzulin szintekkel és a HOMA-értékkel negatív összefüggést mutatott (4. táblázat).
Az általunk használt kritérium-rendszer alapján a vizsgált kohorsz 31,5%-ában igazoltuk a metabolikus szindróma jelenlétét. A metabolikus szindróma előfordulási aránya férfiakban értékelhetően nagyobb volt, mint nőkben (36,6% vs. 27,7%; p<0,01).
Megbeszélés
A metabolikus szindróma egy-egy klinikai gyanújelével (kóros BMI, kóros derék-csípő hányados, hypertonia) önállóan, vagy különböző kombinációkban együttesen rendelkező, nagyszámú felnőtt egyén (n=944) szűrővizsgálatának tapasztalatai az alábbiakban összegezhetők:
1. Az inzulinrezisztencia (hyperinsulinaemia) felismerésében a klinikai gyanújelek jól hasznosíthatók. Az inzulinrezisztencia (hyperinsulinaemia) felismerésében a kóros BMI-nek és a kóros derék-csípő hányadosnak nagyobb jelentősége van, mint a hypertoniának. Több kóros klinikai jel együttes jelenléte az inzulinrezisztencia (hyperinsulinaemia) előfordulási arányának növekedésével jár együtt.
2. A szűréssel a metabolikus szindróma kórfejlődésének korai stádiumában lévő egyének (hyperinsulinaemia+NGT) ismerhetők fel nagyobb arányban (33,2%), a későbbi stádiumok (hyperinsulinaemia+IGT, illetve hyperinsulinaemia+diabetes) kisebb arányban (13,0%, illetve 6,7%) fordulnak elő.
3. A plazma inzulin pozitív korrelációt mutat a vércukorértékekkel, a szérum triglycerid és húgysav értékével, illetve negatív korrelációban van a HDL-cholesterin értékével.
4. A terheléssel felismert glukóz-intolerancia stádiumai között nagyobb arányban (14,4%) IGT, kisebb arányban (9,2%) diabetes előfordulására lehet számítani.
5. Metabolikus szindróma előfordulására a klinikai gyanújeleket hordozó felnőtt egyének kb. egyharmadában (31,5%-ában) számíthatunk. A férfiak között az előfordulás gyakoribb (36,6%), mint a nők csoportjában (27,7%).
6. A metabolikus szindrómában szenvedő egyének időben történő felismerése a primer prevenció alapját teremtheti meg - az érintett egyének azonosításában a legegyszerűbben vizsgálható klinikai paraméterek (vérnyomás, BMI, derékcsípő hányados) hasznos segítséget nyújtanak.
A metabolikus szindróma elméletének posztulálása óta eltelt közel másfél évtized alatt ismereteink sokat bővültek, a szindróma újabb és újabb részleteire derült fény.11 Általánosan elfogadott, hogy az inzulinrezisztencia (hyperinsulinaemia) a domináló meghatározója a szindróma klinikai elemeinek, noha a metabolikus szindróma patomechanizmusának más magyarázatai is napvilágot láttak.12 A helyzet bonyolultságát a WHO 1999-ben kiadott útmutatásának a metabolikus szindróma definícióját megadó első mondata is jelzi.13 Itt ugyanis az olvasható, hogy "nincs nemzetközileg elfogadott meghatározása a metabolikus szindrómának" - bár később mégis feltüntetve szerepelnek a legfontosabbnak tartott kritériumok.
Az elméletben tetten érhető némi bizonytalanság ellenére a gyakorlati teendők egyértelműek, különösen hazánkban. A metabolikus szindróma ugyanis akcelerált atherosclerosishoz vezet, a hazai cardiovascularis eredetű mortalitási mutatók pedig - nemzetközi összehasonlításban is - aggasztóak.14 Nyilvánvaló, hogy a metabolikus szindróma időbeni felismerése megteremti a primer prevenció lehetőségét.
Tanulmányunk során szűrővizsgálatot végeztünk, amelyhez hathatós támogatást kaptunk az alapellátásban dolgozó kollégáinktól. Hazánkban ugyanis a háziorvos van abban a helyzetben, hogy az ellátási területén élőket, családi körülményeiket, familiáris anamnézisüket, életmódjukat ismerje. A szűrővizsgálathoz használt beválasztási kritérium-rendszerünket a lehető legegyszerűbben határoztuk meg, ahhoz kívántunk ugyanis adatokat gyűjteni, hogy az alapvető fizikális jelek (BMI, derék-csípő hányados, vérnyomás) menynyire hasznosíthatók a hyperinsulinaemia (inzulinrezisztencia) felismerésében. Ezen körülmények jelentőségét - mások mellett - a 2-es típusú diabetes szűrésénél is hangsúlyozzuk.15 Egyéb fenotípus-jegyeket16 nem vettünk figyelembe. Az életkori tartomány megállapítása (20-65 év) önkényes volt. A vérnyomás, a BMI, a derék-csípő hányados, a vércukor- és lipidértékek normáliskóros határát a WHO-útmutatásból vettük át.13
A hyperinsulinaemia általunk használt meghatározása egyaránt figyelembe vette az éhomi és a terhelés után 120 perccel mért plazma inzulin értéket. Ezt azért tettük így, mert prospektív klinikai-epidemiológiai tanulmányok egyaránt érveltek az éhomi és az étkezés utáni inzulinszintek prediktív értéke mellett.7,8 A számszerű határérték (éhomi >15 mU/ml, 120 perces terhelés utáni érték >45 mU/ml) megvonása önkényes volt, mert e téren nincs egységes irodalmi álláspont. Módszerünk azonban igazodott más tanulmányok ilyen adatához. Finn szerzők pl. a ł13 mU/ml éhomi inzulinértéket tekintették kórosnak,17 hazánkban Suba és mtsai a normálist meghaladó, "magas" inzulinválaszt állapítottak meg, ha OGTT kapcsán mért bármelyik inzulinszint 50-100 mU/ml értékű volt.18
A hyperinsulinaemiának az atherosclerosis kialakulásában betöltött szerepét elméleti megfontolások vetették fel,6 később ezt prospektív klinikai megfigyelések is megerősítették,7,8 bár napjainkban e szerep egyértelműsége meggyengülni látszik,19,20,21 Nem vitás azonban, hogy a metabolikus szindróma jellegzetességeit mutató egyének kezelésekor - az életmódbeli tanácsok mellett22 - ma is elsősorban olyan gyógyszeres megoldások állnak előtérben, amelyek a meglévő hyperinsulinaemiát, vagy annak további káros következményeit nem fokozzák. Ez igaz az orális antidiabetikus kezelés23,24 és az antihypertensiv terápia25 megválasztásakor is. Már csak ezért is fontos a hyperinsulinaemiás egyének azonosítása.
Bár populációs vizsgálatoknál elfogadott az éhomi inzulinszintet vizsgálni az inzulinrezisztencia jellemzésére,26,27 újabban a HOMA értékét használják ugyanilyen célokra.28 Egyesek inkább a HOMA logaritmikus értékének használhatósága mellett érvelnek,29 mások az eredeti számítási módot tartják jobban alkalmazhatónak.30 Az utóbbi használhatóságát bizonyították egyébként Haffner és mtsai31 populációs adatai is. Normális glukóztolerancia mellett a magas HOMA-érték inzulinrezisztenciára utal, tanulmányunkban - másokhoz hasonlóan32 - a felső quartilisbe eső HOMAértékeket minősítettük kórosnak. A HOMA és az éhomi inzulinszint között - érthető módon - szoros az összefüggés. Kézenfekvő ezért, hogy a hyperinsulinaemiások HOMA-értéke nagyobb, mint a normoinsulinaemiásoké (2. táblázat). Érdekes - bár részben a HOMA-meghatározás képletéből is adódik - az az adatunk, amely szerint mind a normoinsulinaemiások, mind a hyperinsulinaemiások csoportján belül a HOMA értéke a glukóztolerancia romlásával összefüggésben növekedett (2. táblázat). Ezen eredményünk hátterében azonban az is állhat, hogy a hyperinsulinaemia jól ismert módon a 2-es típusú diabetes egyértelmű prediktora.33
A klasszikus cardiovascularis kockázati tényezők jelenlétét hazai szerzők is tanulmányozták, de kevés az olyan felmérés, amely a metabolikus szindróma alapvető tényezőjét, a hyperinsulinaemia (inzulinrezisztencia) jelentőségét is vizsgálta volna. Katona és mtsai34 30-65 év közötti debreceni lakosok (n=19889) adatfelmérését végezték el, s a vizsgált csoport 30,6%-ában mérsékelt fokú (BMI 27-33 kg/m2) és 6,2%-ában kifejezett mértékű (BMI >33 kg/m2) elhízást találtak. A hypertonia előfordulási gyakorisága a testsúlytöbblettel összefüggésben növekedett. Kékes és Berentey35 a magasvérnyomás-betegségben szenvedők cardiovascularis rizikófaktorait mérte fel, s a vizsgált 1476 fő között 35,6%-ban talált elhízott egyént (BMI >30,1 kg/m2). A hypertonia és a testsúlytöbblet (BMI >25,1 kg/m2) együttes előfordulása volt a leggyakoribb (79,7%) a vizsgált csoportban. Ez a tanulmány a glukóz-intolerancia fokát nem analizálta megbízhatóan. Szegedi és mtsai36 Szabolcs-Szatmár-Bereg megyében hypertonia miatt gondozott betegek (n=25526) cardiovascularis rizikófaktorait analizálták, s emelkedett vércukorértéket (a határ számszerű adatának megjelölése nélkül) a különböző alcsoportok 20,7-29,0%-ában figyeltek meg. Pados37 véleménye szerint a hypertoniás betegek metabolikus szövődményeire az esetek 30-40%-ában számíthatunk. Farkas és mtsai38 2-es típusú cukorbetegek (n=804) körében végzett szűrővizsgálatuk során a cardiovascularis kockázati tényezők számottevő halmozódását figyelték meg, az ismert hypertonia társulása pl. a férfiak 64,3%-ában és a nők 76,7%-ában volt megfigyelhető. A mostani vizsgálatunk eredményei leginkább Suba és mtsai18 adataival vethetők egybe. A szerzők 343 beteg vizsgálatáról tudósítanak, valamennyi esetben OGTT-t is végeztek, inzulinszint mérésével egybekötve. A betegeket négy csoportba sorolták: csak elhízottak (n=24), csak hypertoniások (n=35), hypertoniás+centrálisan elhízott (derékcsípő körfogat aránya >1,05) betegek (n=255), illetve normális testsúlyú és vérnyomású egyének (n=29). Az inzulinválasz legmagasabb értéke alapján csoportosították betegeiket alacsony (<20 mU/ml), normális (<50 mU/ml), magas (<100 mU/ml) és extrém magas (>150 mU/ml) értékkel rendelkezőkre. A metabolikus szindróma jellegzetességeit legnagyobb arányban a hypertoniás és centrálisan elhízottak csoportjában találták, itt a betegek 90%-ában a glukózválaszhoz képest magas inzulinszintet és 85%-ban hyperinsulinismust lehetett megfigyelni. A szerzők végkövetkeztetése szerint a metabolikus szindrómában szenvedő egyének a centrális típusú elhízás és a hypertonia jelenléte alapján nagy valószínűséggel felismerhetők. Noha saját szűrővizsgálatunknál is minden esetben elvégeztük az OGTT-t, a beválasztási kritériumaink eltérőek voltak, a kategorizáláshoz más határértékeket használtunk, s adatainkat is kicsit eltérően interpretáltuk. Mégis, következtetésünk (ld. 6. pont) jól egybecseng a szerzők véleményével.
A vizsgált csoportban feltűnő gyakorisággal (93,6%) találtunk olyan egyéneket, akiknek családi anamnézise diabetes mellitus, hypertonia, elhízás vagy korai cardiovascularis megbetegedés vonatkozásában terhelő volt. Ez az adatunk megfelel mások hasonló jellegű megfigyelésének, utalva arra, hogy a metabolikus szindróma genetikai kötöttsége nagy jelentőségű.39 Az öröklődés jelentősége azonban valószínűen nemcsak egy-két generációra terjed ki. Ezzel összefüggésben érdemes megemlíteni, hogy a 2-es típusú diabetes genetikai sajátosságait előtérbe helyező elmélet az emberiség ősközösségi időszakától elindulva, a mai életünk nem egyértelműen szerencsésen alakuló jellegzetességéit is analizálva próbál magyarázatot találni e diabetes-típus napjainkban megfigyelhető rohamos elterjedésére.40
A tanulmányunkban megfigyelhető lipideltérések a 2-es típusú diabetesben észlelhető adatoknak feleltek meg leginkább.41 A szérum triglyceridszint az inzulintartalommal pozitív, a HDL-cholesterin értékével pedig negatív összefüggést mutatott, a szérum össz-cholesterin szint alakulása nem volt jellemző. Napjainkban a szérum magas triglyceridszintjét már elfogadott cardiovascularis kockázati tényezőként tartják számon, a csökkentésére irányuló terápiás erőfeszítések a metabolikus szindrómában mindenképpen indokoltak.42 Nehezebb e betegcsoportban az alacsony HDL-cholesterin-szint növekedését elérni.43
A szérum húgysav mennyiségének növekedését egyesek szintén a metabolikus szindróma jellegzetességei közé sorolják, miután az a cardiovascularis megbetegedések kockázatát növeli.44 Tanulmányunkban a szérum húgysav szint pozitív korrelációt mutatott az éhomi és a postprandialis inzulinszinttel. A WHO szakértői testülete szerint a szérum húgysav vizsgálata nem szükséges a metabolikus szindróma diagnózisának megállapításához.13
Noha nagyszámú (n=944) egyént vizsgáltunk, adataink a metabolikus szindrómára vonatkozóan nem tekinthetők reprezentatívnak. A szűrővizsgálaton való megjelenés előfeltétele volt ugyanis legalább egy gyanújelnek a megléte, amiből adódóan nyilvánvaló, hogy nagyobb arányban vizsgáltunk olyan egyéneket, akiknél számíthattunk további kóros eltérésekre. Fontos adat azonban a hyperinsulinaemia előfordulási gyakorisága (52,9%), illetve figyelemre méltó a glukóz-intolerancia felismerési aránya (23,6%) a vizsgált kohorszban. Kiemelendőnek tartjuk, hogy szűrővizsgálattal a metabolikus szindróma kórfejlődésének korai stádiumában lévő egyének ismerhetők fel nagyobb arányban, a későbbi stádiumok előfordulására egyre kisebb arányban számíthatunk (ld. 2. pont). Hazai viszonylatban új adatnak számít a szűrővizsgálat során megállapított metabolikus szindróma előfordulási gyakorisága (31,5%). Fontos megfigyelés az is, hogy az adott csoportban a férfiak érintettsége kifejezettebb volt, mint a nőké (36,6% vs. 27,7%). Ezek az adataink azonban nehezen vethetők össze más hazai eredményekkel, mert a cardiovascularis kockázati tényezőket felmérő tanulmányok kevésbé voltak "metabolikus szemléletűek", amiből adódóan a glukóz-intolerancia előfordulási arányszámai e vizsgálatokban nem tekinthetők megbízhatónak, illetve e tanulmányokban inzulinszintméréseket nem is végeztek.34,35,36 A Suba és mtsai18 adataival való összevetést pedig az eltérő értékelési módszer teszi nehezen kivitelezhetővé. Adatunk azonban jól egybecseng Eriksson és mtsai22 áttekintő közleményében írtakkal, ugyanis a szerzők a metabolikus szindróma előfordulási gyakoriságát a nyugati országokban 25-35% közöttire becsülik. Úgy látszik tehát, hogy a hazai lakosság érintettsége érdemben nem tér el a nyugati országokban megfigyeltektől.
Összefoglalásképpen annak a reményünknek adunk hangot, hogy adataink hozzájárulnak a metabolikus szindróma hazai jellegzetességeinek árnyaltabb megismeréséhez. A gyanújelek alapján felismert egyének primer prevencióba vonása életmódbeli, étrendi tanácsok adásával kezdődik, ennek eredményességét több tanulmány támasztotta alá.22,45,46 Az érintettek követése, ellenőrzése, szükség esetén gyógyszeres kezelés indikálása képezik azokat a legfontosabb feladatokat, amelyeknek elvégzésében döntő feladat hárul a hazai egészségügyi alapellátás valamennyi szereplőjére. A konziliárusi lehetőségeket a cukorbetegséggel, magas vérnyomással, lipideltérésekkel, elhízással foglalkozó szakambulanciák személyzetének kell biztosítani.47 Az országos méretű felvilágosítás és az egyébként napjainkban egyre inkább halaszthatatlannak minősülő, széles körű teendők koordinálása az egészségügy vezetőinek feladata lehet. Félő azonban, hogy kellő eredményt az egészségügy szereplői önmagukban nem tudnak elérni, ahhoz társadalmi méretű összefogás lenne szükséges.48
Köszönetnyilvánítás
A szűrővizsgálatot a Richter Gedeon Rt. támogatta, a statisztikai analízisben Vargha Péter adott értékes tanácsokat. Segítségüket köszönjük.
A szűrővizsgálat az alábbi háziorvos kollégák segítségével valósult meg: Ardai Jolán dr., Bakos Csaba dr., Budai L. Károly dr., Dániel István dr., Demetrovics Szilárd dr., Duschanek Péter dr., Gábriel Erzsébet dr., Gál Zoltán dr., Greff Zoltán dr., Guth János dr., Hadarits Erzsébet dr., Hámor Katalin dr., Horváth Mária dr., Ihász Judit dr., Jakab Anna dr., Keöd Erzsébet dr., Lábdi Katalin dr., Lakatos Aranka dr., Merczel Ágnes dr., Mihály Sándor dr., Miklós Rozália dr., Papp Cecília dr., Papp Magdolna dr., Pardi Éva dr., Patyi Olga dr., Pesztenlehrer István dr., Poór László dr., Prucsi Valéria dr., Rum János dr., Szabó Ágnes dr., Szabó Ibolya dr., Szilvásy Lajos dr., Varga Alojzia dr., Végh Klára dr., Virágos Imre dr. Valamennyiük fáradozását köszönjük.
Az ETT (137/2001) részbeni támogatásával készült tanulmány.
Irodalom
1. Reaven, GM: The role of insulin resistance in human disease. Diabetes 37: 1595-1607, 1988.
2. Ferrannini, E, Natali A: Essential hypertension, metabolic disorders, and insulin resistance. Am Heart J 121: 1274-1282, 1991.
3. Ferrannini, E, Buzzigoli, G, Bonadonna, R, Giorico, MA, Oleggini, M, Graziadei, L, Pedrinelli, R, Brandi, O, Bevilacqua, S: Insulin resistance in essential hypertension. N Engl J Med 317: 350-357, 1987.
4. Yudkin, JS, Denver, AE, Mohamed-Ali, V, Ramaiya, KL, Nagi, DK, Boubet, S, McLarty, DG, Swai, A: The relationship of concentrations of insulin and proinsulin-like molecules with coronary heart disease: prevalence and incidence. A sudy of two ethnic groups. Diabetes Care 20: 1093-1100, 1997.
5. DeFronzo, RA, Ferrannini, E: Insulin resistance. A multifaceted syndrome responsible for NIDDM, obesity, hypertension, dyslipidemia, and atherosclerotic cardiovascular disease. Diabetes Care 14: 173-194, 1991.
6. Stout, RW: Insulin and atheroma: 20 year perspective. Diabetes Care 13: 631-654, 1990.
7. Pyörälä, K, Savolainen E, Kaukola, S, Haapakoski J: Plasma insulin as coronary heart disease risk factor: relationship to other risk factors and predictive value during 91-year follow-up of the Helsinki Policemen Study Population. Acta Med Scand Suppl 701: 38-52, 1985.
8. Fontbonne, A, Charles, MA, Thibult, N, Richard, JL, Claude, JR, Warnet, JM, Rosselin, GE, Eschwege, E: Hyperinsulinaemia as a predictor of coronary heart disease mortality in a healthy population: the Paris Prospective Study, 15-year follow-up. Diabetologia 34: 356-361, 1991.
9. Zimmet, PZ: Diabetes epidemiology as a tool to trigger diabetes research and care. Diabetologia 42: 499-518, 1999.
10. Fuller, JH, Shipley, MJ, Rose, G, Jarrett, RJ, Keen, H: Coronary heart disease risk and impaired glucose tolerance: the Whitehall study. Lancet I: 1373-1376, 1980.
11. Halmos T: A metabolikus szindróma legújabb vonatkozásai. LAM 8: 84-95, 1998.
12. Barker, DJP, Hales, CN, Fall, CHD, Osmond, C, Phipps, K, Clark, PM: Type 2 (non-insulin-dependent) diabetes mellitus, hypertension, and hyperlipidemia (syndrome x): Relation to reduced fetal growth. Diabetologia 36: 62-67, 1993.
13. World Health Organization: Definition, diagnosis and classification of diabetes mellitus and its complications. Part 1: Diagnosis and classification of diabetes mellitus. Report of a WHO consultation. 1999.
14. Vargáné Hajdú P, Ádány R: A keringési rendszer betegségei okozta korai halálozás trendjei Magyarországon és az Európai Unióban, 1970-1997. Orv Hetil 141: 601-607, 2000.
15. European Diabetes Policy Group 1999: A desktop guide to type 2 diabetes mellitus. Diabetic Med 16: 716-730, 1999.
16. Simon K, Gyulai M, Kórodi T, Winkler G: Fenotípusjegyek értéke a hyperinsulinaemia szűrésében. Diabetol Hung 5: 85-90, 1997.
17. Vanhala, MJ, Kumpusalo, EA, Pitkäjärvi, TK, Takala, JK: Metabolic syndrome in a middle-aged Finnish population. J Cardiovasc Risk 4: 291-295, 1997.
18. Suba I, Halmos T, Kautzky L: Az egyes vizsgálati paraméterek értéke a metabolikus x-szindróma diagnózisában és felkutatásában. Orv Hetil 38: 2407-2411, 1997.
19. Zimmet, PZ: Hyperinsulinemia - how innocent a bystander? Diabetes Care 16 (Suppl 3): 56-71, 1993.
20. Jarrett, RJ: Why is insulin not a risk factor for coronary heart disease? Diabetologia 37: 945-947, 1994.
21. Haller, H: Postprandial glucose and vascular disease. Diabetic Med 14: S50-S56, 1997.
22. Eriksson, J, Taimela, S, Koivisto, VA: Exercise and the metabolic syndrome. Diabetologia 40: 125-135, 1997.
23. Chiasson, JL, Josse, RG, Leiter, LA, Mihic, M, Nathan, DM, Palmason, C, Cohen, RM, Wolever, TMS: The effect of acarbose on insulin sensitivity in subjects with impaired glucose tolerance. Diabetes Care 19: 1190-1193, 1996.
24. Nolan, JJ, Ludvik, B, Beerdsen, P, Joyce, M, Olefsky, J: Improvement in glucose tolerance and insulin resistance in obese subjects treated with troglitazone. N Engl J Med 331: 1188-1193, 1994.
25. Jermendy Gy: Új lehetőség a metabolikus x-szindrómához társuló hypertonia kezelésében. Cardiol Hung 2000/2 Suppl: 13-17, 2000.
26. Laakso, M: How good a marker is insulin level for insulin resistance? Am J Epidemiol 137: 959-965, 1993.
27. Ferrannini, E, Mari, A: How to measure insulin sensitivity? J Hypertension 7: 895-906, 1998.
28. Matthews, DR, Hosker, JP, Rudenski, AS, Naylor, BA, Treacher, DF, Turner, RC: Homeostasis model assessment: insulin resistance and â-cell function from fasting plasma glucose and insulin concentration in man. Diabetologia 28: 412-419, 1985.
29. Fukushima, M, Tanuguchi, A, Sakai, M, Doi, K, Nagata, I, Nagasaka, S, Tokuyama, K, Nakai Y: Assessment of insulin sensitivity from a single sample. Diabetes Care 23: 1434-1435, 2000.
30. Katsuki, A, Sumida, Y, Gabazza, EC, Murishima, S, Furuta, M, Araki-Sasaki, R, Hori, Y, Yano, Y, Adachi Y: Homeostasis model assessment is a reliable indicator of insulin resistance during follow-up of patients with type 2 diabetes. Diabetes Care 24: 362-365, 2001.
31. Haffner, SM, Miettinen, H, Stern, M: The homeostasis model in the San Antonio Heart Study. Diabetes Care 20: 1087-1092, 1997.
32. Isomaa, B, Almgreen, P, Tuomi, T, Forsén, B, Lahti, K, Nissén, M, Taskinen M-R, Groop, L: Cardiovascular morbidity and mortality associated with the metabolic syndrome. Diabetes Care 24: 683-689, 2001.
33. Haffner, SM, Miettinen, H, Gaskill, SP, Stern, MP: Decreased insulin secretion and increased insulin resistance are independently related to the 7-year risk of NIDDM in Mexican-Americans. Diabetes 44: 1386-1391, 1995.
34. Katona É, Páll D, Jenei Z, Polgár P, Karányi Zs, Kakuk Gy: Debrecen túlsúlyos felnőtt lakosainak epidemiológiai adatai, különös tekintettel a cardiovascularis rizikótényezőkre. Magy Belorv Arch 53: 239-243, 2000.
35. Kékes E, Berentey E: A magasvérnyomás-betegségben előforduló cardiovascularis rizikófaktorok. Orv Hetil 142: 819-825, 2001.
36. Szegedi J, Valikovics F, Görögh S: Hypertonia miatt gondozott betegek cardiovascularis rizikófaktorai. Hypertonia Nephrologia 1: 82-89, 1997.
37. Pados Gy: A táplálkozással összefüggő legjelentősebb rizikófaktorok ischaemiás szívbetegségben: dyslipidaemia, obesitas, hypertonia és cukorintolerancia. Orv Hetil 140: 1563-1572, 1999.
38. Farkas K, Noll É, Jermendy Gy: Szív- és érrendszeri megbetegedések kockázati tényezői alapellátásban nyilvántartott nem-inzulindependens cukorbetegek körében. Magyar Belorv Arch 50: 293-298, 1997.
39. Stewart, MW, Humphriss, DB, Berrish, TS, Barriocanal, LA, Trajano, LR, Alberti, KG, Walker, M: Features of syndrome x in first-degreee relatives of NIDDM patients. Diabetes Care 18: 1020-1022, 1995.
40. Hales, CN, Barker, DJP: Type 2 (non-insulin-dependent) diabetes mellitus: the thrifty phenotype hypothesis. Diabetologia 35: 595-601, 1992.
41. Betteridge, DJ: Diabetic dyslipidaemia. Eur J Clin Invest 29(Suppl 2): 12-16, 1999.
42. Paragh Gy, Balogh Z: Atherosclerosis és szekunder dyslipidaemiák. LAM 10: 743-753, 1999.
43. Paragh Gy: A HDL szerepe a cardiovascularis események megelőzésében. Orv Hetil 142: 121-126, 2001.
44. Fang, J, Alderman, MH: Serum uric acid and cardiovascular mortality: The NHANES I Epidemiologic Follow-up Study, 1971-1992. JAMA 283: 2404-2410, 2000.
45. O'Dea, K.: Marked improvement in carbohydrate and lipid metabolism in diabetic Australian aborigines after temporary reversion to traditional life-style. Diabetes 33: 595-603, 1984.
46. Tuomilehto, J, Lindström, J, Eriksson JG, Valle, TT, Hämäläinen, H, Ilanne-Parikka, P, Keinänen-Kiukaanniemi, S, Laakso, M, Louheranta, A, Rastas, M, Salminen, V, Uusitupa, M for the Finnish Diabetes Prevention Study Group: Prevention of type 2 diabetes mellitus by changes in lifestyle among subjects with impaired glucose tolerance. N Engl J Med 344: 1343-1350, 2001.
47. Jermendy Gy: Shared care for diabetic patients in Hungary. Diabetic Med 13: 918-919, 1996.
48. Halmos T, Jermendy Gy: Metabolikus x-szindróma az ezredfordulón. (Elméleti vonatkozások és gyakorlati teendők). Orv Hetil 141: 2701-2709, 2000.
- Közlésre érkezett: 2001. június 1.
- Közlésre elfogadva: 2001. november 10.
- A szerző levelezési címe: Dr. Hidvégi Tibor
- Petz Aladár Megyei Oktató Kórház, IV. Belgyógyászati Osztály
- 9024 Győr, Vasvári Pál u. 2-4.