
Semmelweis Egyetem, Általános Orvosi Kar, II. Belgyógyászati Klinika,1 Budapest, Siófok Kórház-Rendelőintézet, Belgyógyászati Osztály,2 Siófok
FOKOZOTT CARDIOVASCULARIS KOCKÁZAT DIABETESBEN
Somogyi Anikó dr.,1 Simon Kornél dr.2
Összefoglalás
A cardiovascularis betegségek új kockázati tényezői közé tartoznak - mint azt 1996-ban a Bethesda Konferencia elfogadta - a lipoprotein(a), a hypertriglyceridaemia, hyperfibrinogenaemia (és más alvadási tényezők) a balkamra-hypertrophia, a hyperhomocysteinaemia és az oxidatív stressz. E tényezők az ún. klasszikus rizikótényezőkkel, pl. hypercholesterinaemia, hypertonia, diabetes mellitus és dohányzás stb. együtt növelik a cardiovascularis betegségek kockázatát. A cukorbetegek infarctus miatti halálozása 2-4-szerese a nem cukorbetegek halálozásának. A közlemény a diabetes mellitus és a új rizikófaktorok, azon belül kiemelten az oxidatív stressz kapcsolatát tárgyalja a cardiovascularis betegségek kialakulása szempontjából.
Kulcsszavak: diabetes mellitus, oxidatív stressz, cardiovascularis betegség
Increased cardiovascular risk in diabetes
Summary
The 1996 Bethesda Conference acknowledged lipoprotein(a) excess, hypertrigliceridaemia, left ventricular hypertrophy, hyperhomocysteinemia, oxidative stress and hyperfibrinogenemia (among other thrombogenic factors) as possible new cardiovascular risk factors. These conditions associated with "classical" risk factors - hypercholesterinaema, hypertension, diabetes mellitus, smoking ad others -represent an increased risk for cardiovascular disease. Mortality rate from myocardial infarction in diabetic patients is 2-4-fold greater than that in non-diabetic individuals. The article gives an overview about the relationship of diabetes mellitus and the mentioned risk factors - especially oxidative stress - in the development of cardiovascular disease.
Keywords: diabetes mellitus, oxidative stress, cardiovascular risk
Az arteriosclerosis leggyakoribb megjelenési formája az atherosclerosis. Az atheroscleroticus érfalmegvastagodik és részben lágy, lipidekben gazdag (athere: zabkása), részben kemény (scleroticus) fibrotikus vagy kalcifikált összetevőt tartalmazó anyagból áll. Ezek az összetevők különböznek a hypertoniás betegek malignus arterioscleroticus laesióitól, vagy pl. a hialin-arteriosclerosistól.
Az experimentális - később az epidemiológiai vizsgálatok is - az atherosclerosis incidenciájával és klinikai megjelenésével kapcsolatba hozható számos rizikótényezőt tártak fel. Anyicskov vizsgálatai óta, közel 90 éve ismert a hypercholesterinaemia szerepe az érelmeszesedés kialakulásában, és évtizedek óta tudott a dohányzás, a férfi nem és a hypertonia szerepe is. Csak az utóbbi évtizedek vizsgálatai igazolták, hogy cukorbetegség az egyik legfontosabb rizikófaktor. Ugyanakkor az elmúlt években új kockázati tényezőket is felismertek. A cardiovascularis betegségek új rizikótényezői közé tartozik - mint azt 1996-ban a Bethesda Konferencia elfogadta1 - a lipoprotein(a), a hypertryglyceridaemia, hyperfibrinogenaemia (és más alvadási tényezők) a balkamrahypertrophia, a hyperhomocysteinaemia és az oxidatív stressz. E tényezők az ún. klasszikus rizikótényezőkkel együtt növelik a cardiovascularis betegségek kockázatát, de az atherosclerosis kialakulására magyarázatot csak a betegek kétharmadában adnak.
Az arteriosclerosis kialakulásában az endothelsejteknek, a simaizomsejteknek, a macrophagoknak és a korai lipidtárolódásnak van központi szerepe. Különböző patológiás ingerek befolyásolják e sejtek élettani funkcióját és reverzibilis, esetleg irreverzibilis funkcionális változások alakulnak ki. Az endothelsejtek működésbeli változását endothelialis dysfunctiónak nevezzük.2 A patológiás ingerekre a simaizomsejtek proliferálnak és különböző extracelluláris matrix-anyagokat szintetizálnak (pl. kollagén, elasztin, proteoglikánok stb.). A véráram monocytái az intimába migrálnak és az érfalban macrophagokká differenciálódnak. Ez az atherogen migráció az adhéziós molekulák indukcióját okozza. A "helyhez rögzített" sejtek, miközben számos biológiai anyagot szecernálnak, aktív scavanger kapacitással is rendelkeznek, azaz lipideket és sejttörmelékeket fagocitálnak. Ezek a folyamatok megteremtik az alapját a habos sejt (foam cell) képződésének, az érelmeszesedés kialakulásának (1. ábra).
A folyamatot számos tényező elindíthatja, pl. gyulladások, mechanikai hatás (pl. hypertonia), genetikai tényezők, (pl. hyperlipoproteinaemia), kémiai hatások, (pl. dohányzás,) fiziológiás folyamatok (pl. gestatiós diabetes) stb.
"A diabetes a legjelentősebb cardiovascularis kockázati tényező" állapította meg az Amerikai Szívgyógyászati Társaság 1999-ben.
A Framingham Tanulmány több mint 20 éves betegkövetéssel igazolta, hogy cukorbeteg férfiakon kétszer, cukorbeteg nőkön háromszor gyakoribb a cardiovascularis betegség, mint nem cukorbetegeken. Az utóbbi években végzett vizsgálatok a nők veszélyeztetettségét 4-6-szorosra becsülik.3 Az 1. táblázat a diabeteszes nők fokozott cardiovascularis kockázatáról megismert adatokat foglalja össze. Sajnos még csak ismerkedünk azokkal a patogenetikai mechanizmusokkal, amelyek alapját képezik a cukorbeteg nők fokozott vascularis kockázatának.
A DCCT (Diabetes Control and Complications Trial)4 1993-ban és a UKPDS (UK Prospective Diabetes Study)5 1998-ban igazolta, hogy a macro-, ill microvascularis szövődmények kialakulását az egészségesekét megközelítő szénhidrátanyagcsere elérésével lehet leghatékonyabban meggátolni cukorbetegeknél. A 2. táblázat a cukorbetegeknél kívánatos HbA1c- és éhomi vércukorértékeket tünteti fel a nemzetközi ajánlásoknak megfelelően. A 3. táblázat a HbA1c és a macrovascularis kockázat kapcsolatának eddig megismert összefüggéseiről mutat adatokat. Az utóbbi évek kutatásai felhívták a figyelmet a postprandialis vércukorérték fontosságára is az anyagcsere-vezetés során, mert az átmeneti hyperglykaemia is oxidatív stresszt indukál és ezzel elősegíti az érelmeszesedés kialakulását.

1. táblázat. Cukorbeteg nők cardiovascularis kockázata
A nőkön általában később alakulnak ki az ischaemiás szívbetegség tünetei, mint férfiakon (10 évvel később kezdődnek az anginák és 20 évvel később lesz az első infarctusuk). Cukorbeteg nőkön a férfiakéval azonos életkorban jelentkeznek a cardiovascularis betegségre utaló tünetek.
A cukorbeteg nők rizikója 2-4-szer nagyobb, mint a nem cukorbetegeké.
Bár az ischaemiás szívbetegség arány nagyobb férfiakban, mégis több cukorbeteg nő hal meg cardiovascularis betegségben (az ISZB mortalitásában nincs nemi különbség).
Nőknél fokozottan fontos a jó anamnézis, mert a mellkasi fájdalom nagyobb súlyú előjele az epicardialis coronariabetegségnek, mint férfiakban.
Kevésbé - de emelkedik - a nők rizikója, ha magas a cholesterin-, a triglyceridszintjük, a vérnyomásuk, vagy: elhízottak, inaktívak, dohányoznak.
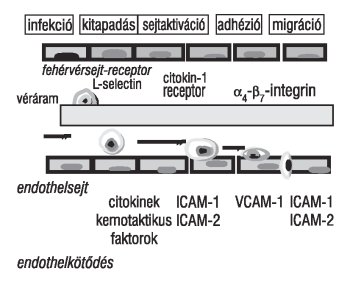
1. ábra. Sejtes válasz a kórokozó noxára (ICAM-1: Intracelluláris adhéziós molekula-1, ICAM-2: Intracelluláris adhéziós molekula-2, VCAM-1: Vascularis sejtadhéziós molekula-1)
A dyslipidaemia diabetesben
A lipidek szerepét az érelmeszesedés kialakulásában már a század elején Anyicskov nyulak cholesterinetetésével igazolta. A 4. táblázaton láthatók a cukorbetegekben észlelhető lipideltérések.
Az 5. táblázatban mutatjuk be a szérumlipidek célértékeit cukorbetegségben.
Átlagosan a cukorbetegek plazmájának cholesterinkoncentrációja nem nagyobb, mint a nem cukorbetegeké.7 Ugyanakkor a cholesterin eloszlása gyakran abnormális, a lipidrészecskék kisebbek, sűrűbbek (kis denzitású LDL), emelkedik a triglycerid és chylomicron koncentrációja, csökken a HDL (high density lipoprotein) -koncentráció. A kis denzitású LDL fontos rizikófaktor, mert könnyen módosul,8 oxidálódik, glikálódik stb., és a megváltozott LDL-molekula korlátlanul képes akkumulálódni a monocyta-macrophagokban. Diabetesben kóros mennyisége már 1,5 mmol/l triglycerid plazmakoncentráció felett kimutatható. Az éhomi és a nem éhomi emelkedett triglyceridszint is a coronariabetegség független rizikófakora. A Copenhagen Male Study a betegek 8 éves követésével igazolta, hogy azok a résztvevők, akik plazmájának triglyceridkoncentrációja a középső (1,5 mmol/l) vagy a felső tartományba esett (2,2 mmol/l), veszélyeztetettebbek, mint az alsó harmadba esők.9 A cukorbetegeknél észlelhető triglyceridben gazdag lipoproteinek maradványai gátolják az endothel "barrier"-funkcióját.10 A szabad zsírsavak emelkedett koncentrációja növeli az endothelialis réteg permeabilitását, elősegíti a simaizomsejtek lipidfelvételét,11 fokozza az endothelium gyulladásos mediátor termelését (NF-
kb aktivációja, interleukin-8-termelés, intercelluláris adhéziós molekula-1 expresszió),12 megváltoztatja in vitro a humán vascularis simaizomsejtek extracelluláris matrix szintézisét,13 inzulinrezisztenciát okoz.14Az érfali lipidlerakódást és egyúttal az atherosclerosis alapját jelentő érfali laesiót (fatty streak) lipidekben gazdag habos sejt (foam cell) macrophagok jellemzik.
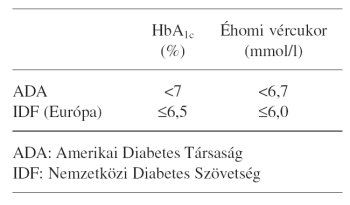
2. táblázat. Célok a szénhidrát-anyagcsere rendezésésben

3. táblázat. A HbA1c-vel jellemzett szénhidrátanyagcsere kapcsolata a macrovascularis rizikócsökkenéssel5

4. táblázat. Lipideltérések diabetesben (elsősorban a 2-es típusban)
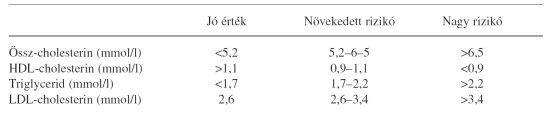
5. táblázat. A szérumlipidek célértékei szövődménymentes cukorbetegeken6
A lipidcseppek a macrophagok cytosol és lysosomalis rekeszeiben tárolódnak. Habos sejteket - főleg macrophagokat - szeparáltak flotációs sűrűségük alapján nyúl-atheromából.15 Az alacsony denzitású sejtek (1,02<d>1,07) négyszer több szabad cholesterint, tizenhétszer több észterifikált cholesterint és tízszer több lysosomalis enzimet -
b-glukozaminidázt, b-galaktozidázt és neutrális glukozidázt - tartalmaztak, mint a nagy denzitású sejtek. A nyúlnak iv. adagolt 125I-LDL-cholesterin gyorsan tárolódik és degradálódik a "fatty streak" laesiók vagy az atheromatosus plakkok macrophagjaiban.16 Tárolódása cholesterinészter formában történik. Morfológiailag hasonló cytosolcseppek alakulnak ki a triglyceridszintézis során.
Glikoziláció és glikoxidáció
A cukorbetegség nemcsak megváltozott szénhidrát-,hanem kóros lipid- és fehérje-anyagcserét is jelent.
A jelen ismereteink szerint kétirányú, de valójában szorosan kapcsolódó - az érelmeszesedés kialakulása szempontjából alapvető - fizikokémiai folyamatot indít el a hyperglykaemia. Egyrészt celluláris változásokat indukál, amelynek jele az oxidatív stressz, következményes szabad gyökös folyamatokkal. A szabad gyökök károsítják-módosítják a környező fehérje-aminosav-lipid struktúrákat. Másrészt nem enzimatikus glikáció is megindul.
A nem enzimatikus glikáció a glukózmolekula kovalens kapcsolódását jelenti aminosavak, fehérjék, lipidek és nukleinsavak szabad aminocsoportjaihoz. Cukorbetegségben a glikáció az inzulindependens sejtekben, a felszíni fehérjestruktúrákban, a keringő fehérjékben és a szöveti fehérjékben figyelhető meg.
A szérumban található glukóz fiziológiás koncentrációban is kapcsolódik fehérjékhez. A glikációnak két formáját ismerjük, a korait és a későit, amelyek függenek a fehérje élettartamától, metabolizmusától. A redukáló - és keringő - cukrok közül a pentóz és a glukóz kapcsolódik a legaktívabban a fehérjék N-terminálisán levő aminocsoportokhoz (a lizinhez és az argininhoz). A folyamat molekuláris oxigén jelenlétében jön létre. A fehérjék viszonylag kisszámú aminocsoportjának glikációja már jelentős hatással van a fehérjék allosztérikus érzékenységére, ligandkötésükre, receptorfelismerő képességükre, enzimaktivitásukra.
Az emelkedett glukózkoncentrációnak kitett keringő fehérjékből (pl. IgG, Hb) és a struktúrfehérjékből (az artériák falának kollagénje, a glomerularis bazálmembrán) Schiff-bázisok, majd fluoreszcens ketoaminszármazékok, instabil, ún. Amadori-termékek képződnek. További kémiai átalakulások (oxidáció, dehidráció, kondenzáció) során AGE (késői glikációs végtermékek - advanced glycation endproducts) termékek alakulnak ki, amelyek a hosszú élettartamú fehérjékhez, mint pl. a kollagén, krisztallin, mielin kapcsolódva irreverzibilis károsodást okoznak (2. ábra). A kialakult termékek proteinázrezisztensek. Mind az oxidatív stressz, mind a fehérjék glikációja kapcsán reaktív aldehidek (pl. malondialdehid, 5-hidroxinonenal stb.) is keletkeznek.
A reaktív aldehidek a fehérjék módosulását és szövetkárosodást okoznak. A reakciót karbonil stressznek hívjuk.17 A reaktív aldehidek detoxikálására három út áll rendelkezésre: a NAD+-függő oxidáció karboxilsavvá, a NADPH-függő redukció alkohollá és a GSH-függő glioxaláz út.18
Az oxidatív és glikációs folyamatok összekapcsolódását mutatja, hogy a glikáció során a glukózmolekula átmeneti fémek (pl.: vas, réz) által katalizált reakció révén autooxidálódik, szabad gyökök, hidrogén-peroxid képeződnek, amelyek fragmentációt és konformációs, strukturális változásokat okoznak a glikozilált fehérjékben. A jelenséget autoxidatív glikozilációnak nevezzük. Az oxidált termékek kialakulása redukálószerekkel, mint pl. aszkorbinsav, tiolok stb. gátolható, ami szintén arra utal, hogy diabetesben a megnövekedett szabadgyök-keletkezés és a nem-enzimatikus glikáció között szoros kapcsolat van.2
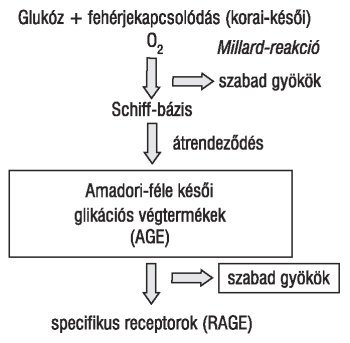
2. ábra. A fehérjeglikáció folyamata és következményei
Mivel a glikoxidációs termékek az öregedés természetes folyamata során is kialakulnak és diabetesben ennek felgyorsulása figyelhető meg, a cukorbetegséget úgy is meghatározhatjuk - legalábbis biokémiai szempontból -, mint egy betegség, amelyet a kollagén felgyorsult öregedése jellemez.
A szabad gyökös reakciók forrásait diabetes mellitusban a 3. ábrán tüntettük fel.
A cukorbetegségben fokozottan jelentkező érelmeszesedés pontos kialakulási okát nem ismerjük. Számos patogenetikai tényezőt tártak fel az utóbbi években és ezek kapcsolata is többé-kevésbé ismertté vált.
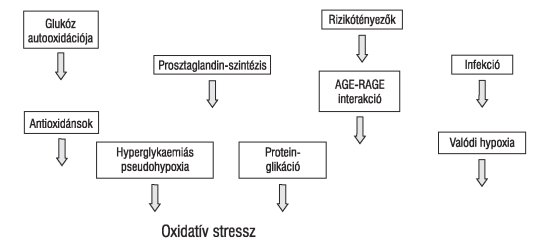
3. ábra. A szabad gyökös reakciók forrása diabetesben (AGE: késői glikációs végtermék, RAGE: AGEreceptor)
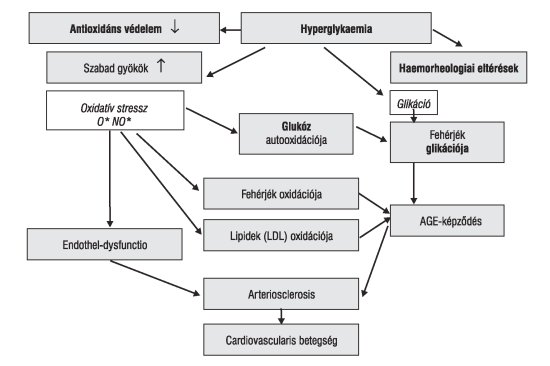
4. ábra. A hyperglykaemia kapcsolata az érelmeszesedéssel
Valószínű, hogy e betegségek alapja örökletes tényezők és/vagy a korai életkorban olyan szerzett faktorok, amelyek komplex anyagcserezavart hoznak létre. Cukorbetegeken a szénhidrát-anyagcsere zavara, a prae- és postprandialis hyperglykaemia alapvető patológiás tényező, mert oxidatív stresszt indukál, a fehérjék glikációját okozza. A cukorbetegek lipoproteinjei - feltehetően elsősorban genetikusan meghatározott okok miatt - könnyen módosulnak a megváltozott környezetben és korlátlanul képesek tárolódni a monocyta-macrophagokban. A folyamatot elősegíti a kialakult endothel-dysfunctio. Az inzulinrezisztencia-hyperinsulinaemia sympathicus hiperaktivitást okoz, neuroendokrin eltérésekkel társul. Csökken az arteriolák myogen válasza, változik a terminális arteriolák és kapillárisok permeabilitása. Megteremtődik a lehetősége a megváltozott struktúrájú-funkciójú lipidek, fehérjék felhalmozódásának (4. ábra).
IRODALOM
1. Pasternak, RC, Grundy, SM, Levy, D, Thomson, PD: 27th Bethesda Conference: matching the intensity of risk factor management with the hazard for coronary disease events. Task Force 3. Spectrum of risk factors for coronary heart disease. J Am Coll Cardiol 27: 978-990, 1996.
2. Ceriello, A: Hyperglycaemia: the bridge between nonenzymatic glycation and oxidative stress in the pathogenesis of diabetic complications. Diab Nutr Metab 12: 42-46, 1999.
3. Niskanen, L, Turpeinen, A, Penttila, I, Uusitupa, MI: Hyperglycamia and compositional lipoprotein abnormalities as predictors of cardiovascular mortality in type 2 diabetes: a 15-year follow-up from the time of diagnosis. Diabetes Care 22 (Suppl. 3): C14-20, 1999.
4. The DCCT Research Group: The effect of intensive diabetes treatment on the development and progression of long-term complications in insulin-dependent diabetes mellitus: the Diabetes Control and Complications Trial. N Engl J Med 329: 977-986, 1993.
5. UK Prospective Diabetes Study Group: Efficacy of atenolol and captopril in reducing risk of macrovascular and microvascular comlications in type 2 diabetes: UKPDS 39. Br Med J 317: 713-720, 1998.
6. Europeian Diabetes Policy Group 1999: A desktop guide to type 2 diabetes mellitus Diabetic Medicine 16: 716-730, 1999.
7. Somogyi A: Diabetes mellitus és lipoproteinek. Orv Hetil 134: 2371-77, 1993.
8. Steinberg, D: Oxidative modification of LDL and Atherogenesis Circulation 95: 1062-1071 1997.
9. Kishore, JH: Potential new cardiovascular risk faktors: left ventricular hypertrophy, homocysteine, lipoprotein(a), triglicerides, oxidative stress, and fibrinogen. Ann Intern Med 131: 376-386, 1999.
10. Henning, B, Chung, BH, Watkins, BA, Alvarado, A: Distribution of endothelial barrier function by lipolytic remnants of triglyceride-rich lipoproteins. Atherosclreosis 95: 235-247, 1992.
11. Laughton, CW, Ruddle, DL, Bedord, CJ, Alderman, EL: Sera containing elevated nonesterified fatty acids from patients with angiographically documented coronary atherosclerosis causes marked lipid accumulation in cultured human arterial smooth muscle-derived cells. Atherosclerosis 70: 233-246, 1998
12. Young, VM, Toborek, M, Yang, F, McCllain, CJ, Hennig, B.: Effect of linoleic acid on endothelial cell inflammatory mediators. Metabolism 47: 566-572, 1998.
13. Olsson, U, Bondjers, G, Camejo, G: Fatty acids modulate the composition of extracellular matrix in cultured human arterial smooth muscle cells by altering the expression of genes for proteoglycan core proteins. Diabetes 48: 616-622, 1999.
14. Roden, M, Price, TB, Perseghin, G, Petersen, KF, Rothman, DL, Cline, GW, Shulman, GI: Mechanism of free fatty acidinduced insulin resistance in humans. J Clin Invest 97: 2859-2865, 1996.
15. Shio, H, Haley, NJ, Flowler, S: Characterization of lipidladen aortic cells from cholesterol-fed rabbits II. Morphometric analysis of lipid-filled lysosomes and lipid droplets in aortic cell populations. Lab Invest 39: 390-397, 1978.
16. Rosenfeld, ME, Carew, TE, von Hodenberg, E, Pittman, RC, Ross, R, Steinberg, D: Autoradiographic analysis of the distribution of 125I-thyramin-cellobiose-LDL in atherosclerotic lesions of the WHHL rabbit. Atheroscler Thromb 12: 985-995, 1992.
17. Wittman I, Wagner L, Pótó L, Wagner Z, Mazák I, Nagy J: Kis molekulasúlyú karbonil stressz termékek kimutatása diabetes mellitusban szenvedő betegek vizeletében. Magy Belorv Arch 53: 49-54, 2000.
18. Baynes, JW, Thorpem SR: Oxidative stress in diabetes. (In: Packer, L, Rösen, P, Tritschler, HJ, King, GL, Azzi, A /eds/: Antioxidants in diabetes, Unesco-MCBN, Marcel Dekker Inc., 2000.) pp. 77-91.
- Közlésre elfogadva: 2002. április 13.
- A szerző levelezési címe: Dr. Somogyi Anikó
- Semmelweis Egyetem ÁOK, II. Belgyógyászati Klinika
- 1088 Budapest, Szentkirályi u. 46.