Józsefvárosi Egészségügyi Szolgálat, Diabétesz szakrendelés, Ferencvárosi Egészségügyi Szolgálat, Gasztroenterológia1 és Semmelweis Egyetem, II. Patológiai Intézet,2 Budapest
A 2-ES TÍPUSÚ DIABETES MELLITUS, A HELICOBACTER PYLORI ÉS A PEPTIKUS FEKÉLY KAPCSOLATA
Buzás György Miklós dr.,1 Illyés György dr.,2 Székely Eszter dr.2
Összefoglalás
A szerzők a 2-es típusú diabetes mellitus, a Helicobacter pylori fertőzés és a peptikus fekély kapcsolatát vizsgálták 86 betegben, összehasonlítva 172 kor és nem szerint azonos nem-cukorbeteg, dyspepsiás kontrollcsoport adataival (eset/kontroll arány 1:2). A fertőzést endoszkópia során vett antrum- és corpus-biopsziából módosított Giemsa-festéssel és ureáz-gyorsteszttel igazolták, a gyulladás stádiumát és aktivitását Bajtai osztályozása szerint értékelték. A diabetes-csoportban az ulcus duodeni 17,4%, az ulcus ventriculi 3,4%-ban fordult elő, arányuk a kontrollcsoportban 28,5% (p=0,042) és 6,3% (p=0,028) volt. A Helicobacter pylori prevalenciája diabetesben 48,2% az antrumban és 44,5% a corpusban, a kontrollcsoportban 57,7% az antrumban (p=0,06) és 52,6% a corpusban (p=0,06). A gyulladás stádiuma alacsonyabb volt a diabetes-csoportban (p=0,03); az aktivitás aránya 32, illetve 54% volt (p=0,03). A 2-es típusú diabetesben a Helicobacter pylori prevalenciája nem szignifkánsan kisebb, a gyulladás stádiuma és aktivitása szignifikánsan alacsonyabb, mint a nem cukorbeteg dyspepsiás kontrollcsoportban. A jelenség részben magyarázhatja a peptikus fekély ritkább előfordulását 2-es típusú cukorbetegségben.
Kulcsszavak: diabetes mellitus, krónikus gastritis, Helicobacter pylori, peptikus fekély
The relationship between type 2 diabetes mellitus, Helicobacter pylori and peptic ulcer
Summary
The authors studied the relationship between type 2 diabetes, Helicobacter pylori infection and peptic ulcer in a case-control study comparing 86 diabetic patients with 172 age- and sex-matched non-diabetic dyspeptic controls. The Helicobacter pylori infection was confirmed from antral and corporeal bioptic samples using the modified Giemsa stain and rapid urease test. The stage and activity of inflammation was assessed using Bajtai's classification. Duodenal ulcer has been found in 17.4% of diabetics and in 28.5% of controls (p=0.042), the prevalence of gastric ulcer being of 3.4% and 6.3%, respectively (p=0.028). The prevalence of Helicobacter pylori infection was of 48.2% in antrum and 44.5% in corpus area of diabetics and of 57.7% in antrum (p=0.06) and 52.6% (p=0.06) in the control's corporeal area. The stage of inflammation was lower in diabetics as compared to controls (p=0.03). Chronic active gastritis was found in 32% and in 54% of the cases (p=0.03). The prevalence of Helicobacter pylori infection is unsignificantly, the severity and activity of the inflammation are significantly lower in type 2 diabetes than in non-diabetic dyspeptic controls. The phenomenon could explain, at least in part, the lower prevalence of peptic ulcer in type 2 diabetes.
Key words: diabetes mellitus, chronic gastritis, Helicobacter pylori, peptic ulcer
Bevezetés
Az évezred fordulóján a diabetes mellitus gyakorisága világszerte növekedőben van és ez a tendencia előrelátható 2025-ig;1 a fejlett országokban és hazánkban is a diabetes prevalenciája kb. 5%.2 A Helicobacter pylori (Hp) a legelterjedtebb fertőzés a világon: prevalenciája 30-40%-os az USA-ban és Nyugat-Európában,3,4,5 Magyarországon 60-70%.6,7 A Hp-fertőzés a nyombélfekélyek több mint 90%-ának és a gyomorfekélyek 60-75%-ának fő patogenetikai tényezője.5 A peptikus fekély prevalenciája 6-10%-os, incidenciája 0,5-1%; az utóbbi két évtizedben e számok csökkenő tendenciát mutatnak.4,5,7 Mindkét betegség magas prevalenciája miatt véletlenszerű együttes előfordulásuk valószínű, éppen ezért az ok-okozati összefüggés tisztázása fontos. Nem új keletű adat, hogy diabetesben a peptikus fekély kevésbé gyakori, mint az a két betegség prevalenciájának alapján elvárható lenne.8,9 Régebbi tankönyvi adatok is ezt támasztják alá.10,11 A Hp felfedezése óta számos tanulmányban különböző módszerekkel értékelték ki a fertőzés prevalenciáját diabeteszes betegcsoportokban,12,13 de az eredmények ellentmondásosak voltak. Dolgozatunk célja a 2-es típusú diabetes, a Hp-fertőzés és a peptikus fekély lehetséges összefüggésének tanulmányozása.
Betegek és módszer
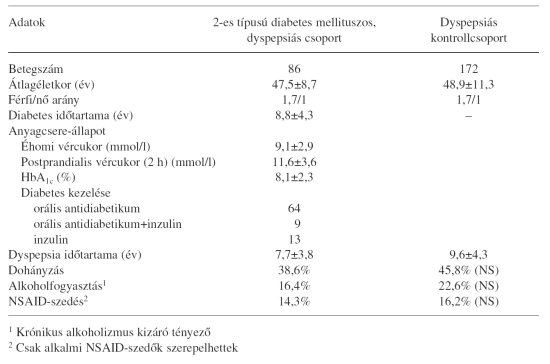
1997-1999 között 86, 2-es típusú diabetes mellitusban szenvedő dyspepsiás betegnél végeztünk szakrendelésünkön felső panendoszkopiát. A 2-es típusú diabetes mellitus diagnózisát az anamnézis, az éhomi és a postprandialis vércukor értékei alapján állapítottuk meg. Az anyagcsere-állapot kiértékelésére az endoszkópos vizsgálatot megelőzően végzett HbA1c és éhomi/ postprandialis vércukorértékeket regisztráltuk. A betegek klinikai, endoszkópos és szövettani adatait összehasonlítottuk 172, azonos időszakban vizsgált, életkor- és nem szerint illesztett kontroll dyspepsiás, nem cukorbeteg egyén adataival (eset/kontroll arány: 1:2). A demográfiai adatokat az 1. táblázatban tüntetjük fel. Az endoszkópos vizsgálatról a betegek írásbeli tájékoztatásban részesültek, erre a célra a Magyar Gasztroenterológiai Társaság Endoszkópos Szekciója által kidolgozott típusnyomtatványt használtuk. A vizsgálatokat Fujinon UGI 7FP és EGH HR2 készülékekkel végeztük. A Hp-fertőzést a nemzetközi standardnak megfelelően 2 antrum és 2 corpus biopsziás mintából mutattuk ki, módosított Giemsa-festéssel és ureázgyorsteszttel. A hematoxilin-eozinnal festett szövettani mintákban kiértékeltük a krónikus gastritis stádiumát és aktivitását Bajtai osztályozása szerint (0=sine morbo; 1=gastritis chronica superficialis; 2=gastritis chronica diffusa; 3=gastritis chronica preatrophica; 4=gastritis atrophica).14 A homogén betegcsoportok biztosítása érdekében kizárási kritériumként szerepeltek a 2. táblázatban feltüntetett körülmények, amelyek befolyásolhatják a Hp prevalenciáját és a vizsgálati módszerek pontosságát.

1. táblázat. Demográfiai adatok (átlag+/-SD)
Statisztika
A Hp-fertőzés és az endoszkópos elváltozások gyakoriságának, valamint a krónikus gastritis intenzitásának csoportok közötti szignifikanciáját "chi"-négyzet teszttel értékeltük ki. A szignifikancia határát p=0,05 értéknél jelöltük meg. A diabetes időtartama, a krónikus gastritis, a HbA1c-szint és a Hp gyakorisága közötti összefüggést Spearman-teszttel határoztuk meg. A feldolgozást a Statistica S.1. Statsoft Ltd., USA programcsomaggal végeztük.
Eredmények
Endoszkópos elváltozások
A diabeteszes csoportban az esetek 17,4%-ában ulcus duodenit, 3,8%-ában ulcus ventriculit észleltünk, míg a dyspepsiás kontrollcsoportban ezek aránya 28,5% (p=0,042), illetve 6,3% (p=0,028) volt.
A Helicobacter pylori gyakorisága
A Hp prevalenciája a diabeteszes betegekben 48,2% volt az antrumban és 44,5% a corpusban, míg a kontrollcsoportban 57,7% az antrumban (p=0,06) és 52,6% a corpusban (p=0,06). A krónikus gastritis stádiuma cukorbetegekben 1,45+/-0,8 volt az antrumban és 1,23+/-0,6 a corpusban, míg dyspepsiás betegeknél 1,96+/-0,9 az antrumban (p=0,03) és 1,68+/-1,1 a corpusban (p=0,03) (1.ábra). A gyulladás aktivitásának aránya 32% volt a diabeteszes és 54% a kontrollcsoportban (p=0,03). A diabetes időtartama és a Hp-gyakoriság között negatív összefüggést találtunk (p=0,0002, r=-0,742); nincs összefüggés viszont a diabetes időtartama és a gastritis intenzitása (p=0,629, r=0,053) (2. ábra), illetve a HbA1c értéke és a Hp prevalenciája között (p=0,783, r=0,062).

2. táblázat. A Hp prevalenciáját befolyásoló, ezért vizsgálataink során az értékelésbe vonást kizáró kritériumok
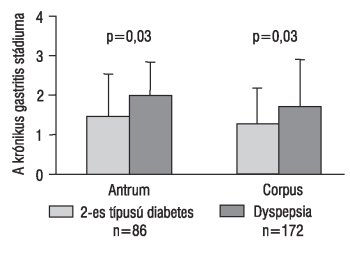
1. ábra. A krónikus gastritis stádiuma a gyomor antrumában és corpusában 2-es típusú diabetesben és a dyspepsiás kontrollcsoportban (Bajtai A. és mtsai osztályozása szerint14)
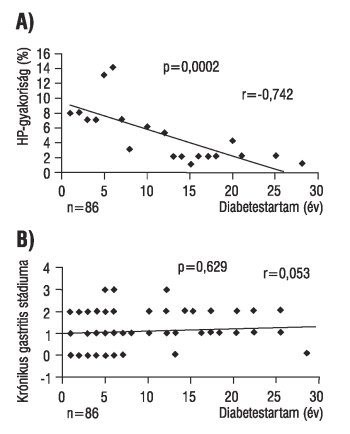
2. ábra: A Helicobacter pylori fertőzés gyakorisága és a 2-es típusú diabetes időtartama (A), illetve a krónikus gastritis stádiuma és a diabetes időtartama közötti összefüggés (B)
Megbeszélés
Évtizedek óta ismert, hogy diabetes mellitusban a peptikus fekély incidenciája és prevalenciája kisebb, mint az átlag-lakosságban. 1959-ben Dotevall az inzulin felfedezése óta közölt irodalomból 24003 beteg adatát gyűjtötte össze és a retrospektív feldolgozásban 173 igazolt esetet talált, amely 0,68%-os prevalenciának felel meg.8 Saját anyagában 1218 cukorbetegnél 1,8%-ban észlelt fekélyt, míg az azonos időszakban közölt angol és skandináv adatok a peptikus fekély 3,9-8,1%-os prevalenciájáról számoltak be. A különbség általában a nyombélfekélyre vonatkozott, gyomorfekély esetében kevésbé volt feltűnő. Vértes és mtsai 1979-ben áttekintve az irodalmat, 128001 cukorbetegnél 1,3%-ban, saját 4408 esetükben 2%-ban találtak fekélyt,9 de a tanulmányokban a mai igényeknek megfelelő kontrollcsoport nem volt. A jelenséget azzal magyarázták, hogy diabetesben a hyperglykaemia és a vagus csökkent érzékenysége miatt a bazális és a hisztaminnal/pentagasztrinnal stimulált HCl-szekréció csökken.15,16,17 A helyzetet tovább bonyolította a Hp felfedezését követő epidemiológiai tanulmányok özöne, amelyek majdnem minden betegségnek kapcsolatát vélték felfedezni a fertőzéssel.18 Nem volt kivétel a diabetes sem (3. táblázat).18 A Hp-érában azonban nem született humán tanulmány a HCl-szekréció változásairól diabetesben, viszont kísérleti adatok igazolták, hogy streptozotocin indukálta diabetesben patkányban a vagus elektromos ingerlése és a pentagasztrinnal stimulált HCl-termelés csökken;19 az inzulin kiváltotta HCl-szekréció szintén csökken hasonló modellben és ezt a jelenséget az NO közvetíti, amely a glucopenia centrális hatását mediálja.20 Alloxán-diabeteszes patkányban a bazális és hisztamin indukálta HCl-szekréció csökken a sérült vagus és H2-receptor aktivitás miatt.21 Bár e kísérletes adatok bepillantást engednek a HCl-szekréció csökkenésének biokémiai mechanizmusaiba, a mi szempontunkból tovább nem jutottunk, mivel a laboratóriumi patkányok általában nem Hp-fertőzöttek. A HCl-szekréciót tovább kell tanulmányozni Hp-pozitív és -negatív diabeteszes betegekben; ilyen tanulmány még nem készült.
A nemzetközi irodalomban is elsőként Simon és mtsai mutatták ki 311 diabeteszes esetben, hogy a Hp-fertőzés gyakorisága nagyobb az átlagosnál és nem az életkorral, hanem a diabetes fennállásának időtartamával függ össze.12 Másik hazai munkacsoport szerológiai módszerrel diabetes mellitusban 82%-os Hp-prevalenciát észlelt, amely szintén nagyobb volt a kontrollcsoport értékénél.22 Holland tanulmányban13 2-es típusú diabetes mellitusban az IgA és IgG Hp-ellenes antitestek magasabb prevalenciáját észlelték minden korcsoportban, de a különbség csak a 60 év felettiek esetében volt szignifikáns. Olasz és tajvani

3. táblázat. Helicobacter pylori fertőzéssel asszociált extragastricus kórképek* (módosítva G. Realdi és mtsai után18)
* Az asszociáció egyetlen esetben sem igazolt tudományos bizonyítékok alapján, ezért a nemzetközi és hazai konszenzus szerint6 mindezen kórképekben az eradikációs kezelés a kontrollált tanulmányokon kívül nem indokolt
adatok szerint 2-es típusú diabetesben a Hp szeroprevalenciája nem különbözik az átlagostól.23,24 Újabb magyar tanulmányban25 szerológiai módszerrel nem találtak összefüggést a diabetes típusa, időtartama és a Hp gyakorisága között. Nemzetközi, 891 fős betegcsoportban (240 2-es típusú, 145 1-es típusú diabeteszes + 506 kontroll) sem találtak különbséget a Hp-prevalenciájában az egészséges és diabeteszes betegek között.26 Török lakosságban 2-es típusú diabetesben a prevalencia 80, az egészséges kontrollcsoportban 56%.27 Ausztrál tanulmányban 380 2-es típusú diabeteszes betegben és 170 kontrollegyénnél a Hp szeroprevalenciája 33, illetve 32% volt, és életminőségkérdőívvel kimutatták, hogy a dyspepsiás tünetek nem gyakoribbak diabetesben, mint az általános lakosságban.28 Újabb olasz felmérések szerint sem magasabb a Hp prevalenciája 2-es típusú diabetesben,29 162 2-es típusú diabeteszes és 164 dyspepsiás kontroll esetében a peptikus fekély ritkább volt a cukorbetegekben (20,1 vs. 29,3%), a Hp-fertőzés viszont gyakoribb (74,4 vs. 50%); neuropathiás esetekben a Hp-prevalenciát 84,7%-nak találták és a dyspepsia is gyakoribb volt, de függetlenül a Hp-statustól.30 Az irodalmi adatok tehát ellentmondásosak.
Eredményeink szerint 2-es típusú diabetesben
a.) a Hp prevalenciája mind az antrumban, mind a corpusban nem szignifikánsan kisebb, mint a dyspepsiás betegcsoportban;
b.) a krónikus gastritis stádiuma és aktivitása kisebb diabeteszes betegeknél és nem függ a diabetes időtartamától;
c.) a Hp prevalenciája és a diabetes időtartama között negatív összefüggés van;
d.) nincs összefüggés a Hp-prevalencia és a HbA1c-vel jellemzett anyagcsere-állapot között;
e.) az endoszkóposan igazolt peptikus fekély ritkább diabetesben, mint a dyspepsiás kontrollcsoportban.
Tekintetbe kell vennünk azonban, hogy a betegek beválogatása dyspepsiás panaszaik alapján történt, ezért sem a diabeteszes, sem a dyspepsiás betegek nem képviselik a teljes cukorbeteg-, illetve általános populációt.
A Hp-fertőzés akvirálása gyermek- és fiatalkorban történik, a 2-es típusú diabetes általában a 40 év felettiek betegsége; ezért valószínűleg a diabetes kezdetekor a betegek már fertőzöttek és ennek aránya megfelelhet az átlagos lakossági fertőzöttségnek. A Hp prevalenciája növekszik az életkorral, de ez kohorsz-jelenség,4 és nem az idővel fokozódó fertőződést jelenti. Egyes szerzők13 a nagyobb prevalenciát a humorális és celluláris immunválasz csökkenésével és a cukorbetegek gyakoribb hospitalizációjával magyarázzák. A diabetes hajlamosít a fertőzésekre, ez azonban a légúti, húgyúti, végtagi és lágyrész-fertőzésekre vonatkozik,31,32 a gastrointestinalis fertőzésekre nem. A Hp-asszociált gyomorcarcinoma és MALT-lymphoma diabetesben sem gyakoribb az átlagosnál, bár a diabetes nagyobb kockázatot jelent a pancreas-, vese és az endometrialis carcinoma esetében.33 A Hp-fertőzés krónikus aktív gyulladást okoz a gyomorban, amelynek súlyossága és kiterjedése függ a baktériumtörzstől és a virulenciafaktoroktól, illetve a gazdaszervezet immunológiai válaszától. A krónikus Hp-fertőzés a corpus nyálkahártyájának gyulladása révén a gyomorsavtermelés csökkenéséhez vezet.34 A cukorbetegek HCl-termelésére vonatkozó adatok a Hp-éra előtti évtizedekből származnak és valószínűleg nemcsak a diabetes, hanem a Hp-fertőzés következményei. A tumor necrosis faktor-alfa (TNF-alfa) fokozott mértékben képződik a Hp-fertőzött gyomornyálkahártyában,35 és az is tudott, hogy az elhízott 2-es típusú diabeteszes betegeknél a keringő TNF-alfa bioaktivitása nagyobb.35,36 Feltételezhető, hogy a HCl-szekréció csökkenését diabetesben a lokális és keringő TNF-alfa magasabb szintje okozza. A Hp indukálta krónikus gastritisben megváltozik a gyulladást elősegítő (interleukin-1, -6, -8, -12, TNF-alfa, PGI2, PGE2), illetve gátló (IL-3, -4, -10) citokinek és kemokinek aránya. A diabetesben fellépő immunszuppresszió a lokális immunválasz down-regulációjához vezethet. Hp-fertőzésben az epithelialis sejtek baktérium és citokinek indukálta apoptosisa, valamint a sejtproliferáció megnövekszik, és a sejtkinetika változásai hozzájárulhatnak a nyálkahártya sérüléseinek kialakulásához,37 de nem ismert, hogy a diabetes befolyásolja-e ezen folyamatokat. 2-es típusú diabetesben a leptintermelés károsodott és leptinrezisztencia alakulhat ki.38 A leptint azonban nemcsak a zsírsejtek termelik, hanem a gyomor epitheliumsejtjei is. Kísérleti modelleken a leptin gastroprotectiv hatású, csökkenti a HCl-termelést és lokális prosztaglandin-felszabaduláshoz vezet.39 Hp-fertőzésben a keringő leptin szintje nem változik, de a nyálkahártyában megnövekszik a leptinexpresszió, amely az eradikációs kezelés után csökken.40 A fenti tényezők magyarázhatják azt, hogy betegeinkben a krónikus gastritis stádiuma és aktivitása kisebb, illetve a peptikus fekély ritkább, mint a kontrollcsoportban. Mindezen hipotetikus összefüggések tisztázása a jövő egyik kutatási területe lehet.
Köszönetnyilvánítás
A statisztikai feldolgozás és ábrák készítéséért köszönettel tartozom Józan Jolánnak (Országos Baleseti és Sürgősségi Intézet, Kísérleti Osztály).
IRODALOM
1. King, H, Aubert, RE, Herman, WH: Global burden of diabetes 1995-2025. Diabetes Care 21: 1414-1431, 1998.
2. Kerényi Zs: A diabetes mellitus epidemiológiája. (In: Halmos T, Jermendy Gy /szerk/: Diabetes mellitus. A cukorbetegség klinikai vonatkozásai. Medicina, Budapest, 1997.) pp. 51-68,
3. Everhart, JE, Moran, DK, Perez-Perez, GI, Tealka, TS, McQuillan, G: Seroprevalence and ethnic differences in Helicobacter pylori infection among adults in the United States. J Infect Dis 181: 1359-1363, 2000.
4. El-Serag, HB, Sonnenberg, A: Opposing time trends of peptic ulcer and reflux disease. Gut 43: 327-333, 1998.
5. Cave, DL: Helicobacter pylori: Epidemiology and pathogenesis. (In: Brandt, LJ /szerk./: Clinical practice of gastroenterology. Churchill-Livingstone, Philadelphia, 1999.) pp. 273-281.
6. Tamássy K, Simon L, Mégraud, F: Helicobacter pylori infekció magyarországi epidemiológiája (szeroepidemiológiai összehasonlító tanulmány). Orv Hetil 136: 1387-1393, 1995.
7. Rácz I, Bajtai A, Lonovics J, Simon L: Helicobacter pylori. A Magyar Gasztroenterológiai Társaság consensus értekezletének anyaga. MGT-Medicom, Budapest, 2000.
8. Dotevall, G: Incidence of peptic ulcer in diabetes mellitus. Acta Med Scand 164: 463-472, 1959.
9. Vértes L, Forgács S, Osváth J: Diabetes mellitus és fekélybetegség. Magyar Belorv Arch 32: 231-236, 1979.
10. Magyar I: Az emésztőszervek betegségei diabetesben. (In: Magyar I, Tamás Gy /szerk./: Diabetes mellitus, Medicina, Budapest, 1979.) pp. 347-350,
11. Haller, H, Reding, R: Begleitkrankheiten des Diabetes mellitus. Sonstige Magenerkrankungen beim Diabetiker. (In: Bibergeil, H /szerk./: Diabetes mellitus. VEB Gustav Fischer Verlag, Jena, 1978.) pp. 411-418,
12. Simon L, Tornóczky J, Tóth B, Jámbor M, Sudár Zs: Campylobacter pylori fertőzés jelentősége a gasztroenterológiában és diabetológiai gyakorlatban. Orv Hetil 130: 1325-1329, 1989.
13. Oldenburg, B, Diepersloot, RJA, Hoekstra, JBL: High seroprevalence of Helicobacter pylori in diabetes mellitus. Dig Dis Sci 41: 458-461, 1996.
14. Bajtai A, Figus IA, Simon L, Bánki Gy: A chronicus gastritis. IV. Adatok a chronicus gastritis patológiájához. Orv Hetil 113: 2511-2516, 1972.
15. Dotevall, G: Gastric secretion of acid in diabetes mellitus during basal conditions and after maximal histamine stimulation. Acta Med Scand 59-68, 1961.
16. Fixa, B, Komarkova, O, Hereont, V, Kos, J: Gastric secretory disturbances in diabetes. Am J Dig Dis 9: 477-483, 1964.
17. Marks, IN, Shuman CR, Shay, H: Gastric acid secretion in diabetes mellitus. Ann Int Med 51: 227-232, 1959.
18. Realdi, G, Dore, MP, Fastame, L: Extradigestive manifestations of Helicobacter pylori infection. Fact and fiction. Dig Dis Sci 44: 229-236, 1999.
19. Tashima, K, N ishijima, M, Fujita, A, Kubomi, M, Takeuchi, K: Acid secretory changes in streptozotocin-diabetic rats: different responses to various secretagogues. Dig Dis Sci 45: 1352-1358, 2000.
20. Baydoun, R., Dunbar, JC.: Impaired insulin but normal pentagastrin effect on gastric acid secretion in diabetic rats: a role for nitric oxid. Diabetes Res Clin Pract 38: 1-8, 1997.
21. Ozcelikay, A, Altan, T, Yildizoglu, AN, Onur, F, Ozturk, Y: Basal and histamine-induced gastric acid secretion in alloxan diabetic rats. Gen Pharmacol 24: 121-126, 1993.
22. Gerencsér Zs, Juhász P, Nemesánszky E: Prevalence of anti-Helicobacter pylori antibodies in hospitalized diabetic and alcoholic patients. Zschr Gastroenterol 72: A22, 1993.
23. Bilotta M, Pacifico A., Malaty, HM, Dore, NP, Pisanu, G, Maioli, M, Realdi, G: Seroprevalence of Helicobacter pylori in diabetic patients. Ital J Gastroenterol Hepatol 29: 12, A87, 1997.
24. Kao, CH, Pan, DY, Wang, SJ, Chen, GH: The relationship between H. pylori and gastric empyting in patients with non-insulin dependent diabetes mellitus. Eur J Nucl Med, 22: 122-125, 1995.
25. Kozák R, Juhász E, Horváth Gy, Harcsa E, Lövei L, Sike R, Szele K: Diabetes mellitusos betegek Helicobacter pylori fertőzöttsége. Orv Hetil 140: 993-995, 1999.
26. Dore, M, Bilota, M, Malaty, HM, Pacifico, A, Maioli, M, Graham, DY, Realdi, G: Diabetes mellitus and Helicobacter pylori infection. Nutrition 16: 407-410, 2000.
27. Guvener, N, Akcan, Y, Paksoy,I, Soylu, AR, Aydin, M, Arsléan, S, Gedik, O: Helicobacter pylori associated gastric pathology in patients with type II diabetes mellitus and its relationship with gastric emptying: the Ankara study. Exp Clin Endocrinol Diabetes, 107: 172-176, 1999.
28. Xia, HH, Talley, NJ, Kam, EP, Young, LJ, Hammer, J, Horowitz, M: Helicobacter pylori is not associated with diabetes mellitus, nor with upper gastrointestinal symptoms in diabetes in diabetes mellitus. Am J Gastroenterol 96: 2001, 1039-1046.
29. Quadri, R, Rossi, C, Cataflamo, E, Masoero, G, Lombardo, L, Della-Monica, P, Rovera, L, Pera, A, Cavella-Perlin, P: Helicobacter pylori infection in type 2 diabetic patients. Nutr Metab Cardiovasc Dis 10: 263-235, 2000.
30. Gentile, S, Turco, S, Oliviero, B, Torella, R: The role of autonomic neuropathy as a risk factor of Helicobacter pylori infection in dyspeptic patients with type 2 diabetes mellitus, Diabetes Res Clin Pract 42: 41-48, 1998.
31. Josh, N, Caplito, GN, Wettekamp, MR, Kirchner, AV: Infections in patients with diabetes mellitus. New Engl J Med 341: 1906-1911, 1999.
32. Kovács G, Szalka A: Diabetesben gyakran előforduló infekciós kórképek és kezelésük. Diabetol Hung 5: 235-244, 1997.
33. Trichopoulos, D, Lipworth, L, Petridou, E, Adami, HO: Epidemiology of cancer. (In: De Vita VT Jr., Hellman S, Rosenberg SA [eds.]: Principles and practice of oncology. Lippincott-Raven Publishers, Philadelphia-New-York, V. kiadás, 1997.) pp. 231-259.
34. Calam, J: Helicobacter pylori modulation of gastric acid. Yale J Biol Med 72: 195-202, 1999.
35. Winkler G, Salamon F, Simon K Cseh K: Tumor necrosis faktor-alfa: az elhízás inzulinrezisztencia-nem inzulindependens diabetes mellitus kapcsolat lehetséges patogenetikai faktora? Orv Hetil 139: 1627-1632, 1998.
36. Treszl A, Vásárhelyi B, Tulassay Zs, Szathmári M: A tumor nekrózis faktor-alfa élettana és szerepe egyes betegségek patogenezisében. Magy Belorv Arch 53: 397-402, 2000.
37. Ernst, RB, Reyes, VE, Fan, XJ, Crowe, SE: Cytokineinduced, Helicobacter pylori-induced epithelial cell apoptosis. (In: Hunt, RH, Tytgat, GNJ /szerk./: Helicobacter pylori. Basic mechanisms to clinical cure. Kluwer Academic Publishers, Dordrecht, Boston, London, 1998.) pp. 123-130.
38. Udvardy M, Káplár M: A 2-es típusú diabetes mellitus. (In: Leövey A /szerk./: A klinikai endokrinológia és anyagcserebetegségek kézikönyve. Medicina Könyvkiadó Rt., Budapest, 2001.) pp. 829-855.
39. Konturek, PC, Konturek, SJ, Brzozowski, P, Jaworek, J, Hahn, EG: Role of leptin in the stomach and pancreas. J Physiol 95: 345-354, 2001.
40. Azuma, T, Suto, H, Ito, Y, Ohtani, M, Dojo, M, Kuriyama, M, Kano, T: Gastric leptin and Helicobacter infection. Gut 49: 324-329, 2001.
- Közlésre elfogadva: 2002. január 19.
- A szerző levelezési címe: Dr. Buzás György Miklós
- Józsefvárosi Egészségügyi Szolgálat, Diabétesz szakrendelés
- 1084 Budapest, Trefort u. 3.