Budai Gyermekkórház-Rendelőintézet, Budapest,1 Országos Epidemiológiai Központ, Budapest2
AZ 1-ES TÍPUSÚ DIABETES MELLITUSBAN SZENVEDŐ GYERMEKEK HUMORÁLIS IMMUNVÁLASZKÉSZSÉGÉNEK FELMÉRÉSE
Sztranyák Anikó Tamara dr.,1 Szolnoky Miklós dr.,1 Karacs Ildikó dr.,2 Mezey György János dr.,1 Blatniczky László dr.,1 Kalmár Ágnes dr.1
Összefoglalás
A szerzők célkitűzése az 1-es típusú diabetes mellitusban szenvedő gyermekek humorális immunválasz-készségének, ezen belül a specifikus antitesttermelő képességének részletes felmérése volt. A pneumococcus és a b típusú Haemophilus influenzae capsularis poliszacharid elleni antitestek mennyiségét ELISA módszerrel, a diphtheria- és a tetanustoxoid elleni antitest szérumkoncentrációját passzív hemagglutinációval vizsgálták. Az eredmények alapján a 129 diabeteszes gyermek közül alacsony (<50mg/l) pneumococcus capsularis poliszacharid elleni antitest értéket 101 betegben találtak: az 5-10 éves diabeteszes gyermekek 63%-ában, a 10 év feletti korosztály 48%-ában (kontroll: 48, illetve 42%). A különbség mindkét korcsoportban szignifikáns. A beteg- és a kontrollcsoport b típusú Haemophilus influenzae capsularis poliszacharid, diphtheria- és tetanus toxoid elleni antitest titerét vizsgálva nem észlelhető szignifikáns eltérés. A szuboptimális (<100mg/l) pneumococcus-ellenes antitest titerrel rendelkező gyermekek Pneumovax23 védőoltással történő immunizálása után a betegek 78%-a volt képes protektív antitestszint elérésére. A szerzők megállapítják, hogy a betegek diphteria és tetanus toxoiddal, valamint b típusú Haemophilus influaenzae-vel szembeni antitestjeinek koncentrációja kellő védettséget nyújt. Pneumovax23 védőoltással a Streptococcus pneumoniae törzsek ellen is protektív immunválasz érhető el.
Kulcsszavak: humorális immunválasz, 1-es típusú diabetes mellitus, vakcináció
Humoral immune response of the children with type 1 diabetes mellitus
Summary
The authors' aim was to assess the humoral immune response, especially the specific antibody production of the children suffering from type 1 diabetes mellitus. The anti-pneumococcal and the anti-Haemophilus influenzae type b capsular polysaccharide antibody titers were investigated by ELISA, while the anti-diphtheria and anti-tetanus toxoid antibody concentrations by passive haemagglutination methods in 129 children suffered from diabetes. The anti-pneumococcal capsular polysaccharide antibody titers were found to be low (<50mg/l) in 101 patients. In detail, 63% of the diabetics aged 5-10 years and 48% older than 10 years had low anti-pneumococcal capsular polysaccharide antibody levels (controls: 48% vs. 42%, p<0,05). Regarding the anti-Haemophilus influenzae type b capsular polysaccharide, anti-diphtheria and anti-tetanus toxoid antibody concentration, significant difference was not found comparing the patients and controls. Patients having suboptimal (<100mg/l) anti-pneumococcal antibody titers mounted protective response after the antigen challenge (Pneumovax23) in 78% of the patients. Authors' conclusion is, that antidiphtheria, anti-tetanus toxoid and anti-Haemophilus influenzae type b capsular polysaccharide antibody concentrations of the diabetic children reach protective level, while immunization against Streptococcus pneumoniae strains is demanded in most of the patients to confer protective immunity.
Key words: Humoral immunity, type 1 diabetes mellitus, vaccination
A diabetes mellitusban szenvedő betegekben immunológiai diszfunkció áll fenn. A diabeteszes betegek fertőzésekre való fogékonyságának növekedése valószínűleg multifaktoriális, kiemelten fontos a hyperglykaemia szerepe. Károsodik a neutrophilek és a macrophagok funkciójának széles köre, beleértve a kemotaxist, az adherenciát, a phagocytosist és a mikroorganizmusok intracelluláris ölő mechanizmusát. Mind humán megfigyelések, mind állatkísérletek igazolták, hogy diabetesben az intracelluláris ölőképesség csökken bizonyos kórokozókkal szemben (Staphylococcus aureus, Candida albicans), különösen rosszul beállított anyagcsere esetén. Az 1-es típusú diabetes mellitusban (1TDM) immundefektusra való genetikai prediszpozíció növelheti a fertőzések iránti fogékonyságot. Az immundeficiencia magában foglalhatja a csökkent komplementszintet a szérumban (az 1-es típusú diabetes mellitusban szenvedő betegek 25%-ának csökkent a C4-koncentrációja) és a megváltozott T-lymphocyta alosztályokat, beleértve a T-helper lymphocyta szám relatív csökkenését.1 Megfigyelték azt is, hogy a természetes ölősejtek (natural killer - NK-sejtek) aktivitása fokozott, ami autoimmun betegségekre prediszponál és a praediabetes része is lehet2 A humorális immunitással - ezen belül is elsősorban a specifikus antitesttermelő képességgel - kapcsolatban azonban alig áll rendelkezésünkre információ.
Az irodalmi adatok szerint az 1-es típusú diabetes mellitusban szenvedő gyermekek esetében a fertőzések nagyobb gyakorisága nem jellemző, de a poliszacharid és protein antigének ellen kialakuló védekezőképességgel kapcsolatban nincsenek vizsgálati eredmények.3
Célkitűzésünk az volt, hogy klinikai vizsgálat keretében mérjük fel az 1TDM-ban szenvedő gyermekek humorális immunválasz-készségét. A vizsgálati protokoll kidolgozása a primer immunhiány nemzetközileg elfogadott kivizsgálási menetéhez igazítottan történt.4 Meghatároztuk a betegek thymus-dependens és -independens antigénekkel, azaz bizonyos bakteriális protein, valamint poliszacharid antigénekkel szembeni antitest szintjét, majd alacsony antitestszint esetén, tesztimmunizációt követően, az antitesttermelő képességet mértük fel ugyanazon antigének vonatkozásában. A nemzetközi irodalom nem megfelelő antitestválasznak tekinti, ha a beteg nem képes legalább háromszoros antitesttiteremelkedéssel reagálni az antigénstimulációra, és ezt specifikus antitesthiányos állapotként diagnosztizálja.5
Vizsgált személyek és módszerek
A specifikus antitesttermelő képesség felmérésére vonatkozó vizsgálatainkat a Budai Gyermekkórház Diabetológiai szakrendelésén gondozott 129 1TDM-ban szenvedő betegben végeztük el. A vizsgálatban részt vevő betegek életkorukat tekintve az 5-től 22 évesig terjedő korosztályba tartoztak, többségükben 9-10 éve állnak 1TDM miatt gondozás alatt. Az átlagos életkor és a szórás 14,8+/-4,34 év volt. Az 1-5 éves korcsoportba kevés betegünk tartozott és szüleik többsége nem adta beleegyezését a vizsgálathoz, ezért az ő adataikat nem tudtuk felhasználni a vizsgálathoz. Eredményeinket emiatt két korcsoportra bontva (5-10 éves és >10 éves) értékeltük.
Kontrollcsoportként 98, immunológiai betegségben nem szenvedő, hasonló (5-19 éves) korú gyermek szérum mintáját elemeztük, akik laboratóriumunkban egyéb okból vérvételre jelentkeztek (a prospektív vizsgálatot a Budai Gyermekkórház Etikai Bizottsága engedélyezte, a szülők pedig előzetes tájékoztatás után írásban beleegyezésüket adták hozzá). Az átlagéletkor és a szórás 9,8+/-3,2 év volt.
Az alacsonyabb életkori átlag annak tudható be, hogy a kontroll gyermekek életkori eloszlása egyenletesebb, míg a diabeteszes csoportban a >10 évesek között már nagykorúak (>18 év) is vannak.
Az antitest-koncentrációk meghatározásával párhuzamosan a diabeteszes gyermekek körében retrospektív kérdőíves felmérést végeztünk a fertőzések gyakoriságára, típusára, súlyosságára vonatkozóan. (Az elmúlt évben hányszor volt beteg?, Hányszor betegszik meg a gyermek évente?, Milyen lokalizációjú fertőzései voltak?, Mennyi ideig tartott a betegség?, A fertőző gyermekbetegségeket megkapta-e?, Ha igen, milyen volt a lefolyása?, Védőoltásokat megkapta-e?, Időpontjai?, Pneumovax23, PedvaxHib védőoltást kapott-e, ha igen, mikor?). Az antitestek vizsgálata két lépésben történt. Az első lépés a pneumococcus- (PCP) és a b típusú Haemophilus influenzae (Hib) capsularis poliszacharid elleni alap antitest mennyiségének meghatározása, a második az esetleges vakcináció utáni antitesttiter meghatározása volt. A diphtheria- (Di-AT) és a tetanus toxoid elleni antitest (Te-AT) esetében a kötelező DiPerTe védőoltások után kialakult ellenanyagszintet mértük. Azon gyermekek, akikben a vizsgált antitestek mennyisége nem érte el az adott kórokozóval szembeni normálérték alsó határát, tesztimmunizációban részesültek Pneumovax23 (MSD), ill. ActHib (MSD) védőoltással. A vakcináció után következett a második antitest-meghatározás az antitesttermelő képesség megítélése szempontjából, a védőoltás beadása után 4 héttel.5
A tesztimmunizáció után mért antitest koncentráció alapján a betegeket 3 csoportba osztottuk. Az I. csoportba kerültek azok, akikben >10-szeres, kitűnő védettséget nyújtó titeremelkedés volt tapasztalható, a II. csoportot a 3-10-szeres titeremelkedést mutatók, míg a III. csoportot azok alkották, akikben nem volt észlelhető legalább háromszoros titeremelkedés.5,6,7
A pneumococcus és a b típusú Haemophilus influenzae capsularis poliszacharid antigén ellen termelt antitestek meghatározását ELISA módszerrel végeztük el (The Binding Sites, Birmingham, UK).
A módszerben alkalmazott pneumococcus capsularis poliszacharid (PCP) antigén a 23 leggyakoribb Streptococcus pneumoniae törzset, a virulens törzsek 80%-át reprezentálja.8 A b típusú Haemophilus influenzae (Hib) ELISA esetében az antigén a szilárd fázisú Hib capsularis poliszacharid antigén.9
Populációs felmérés alapján a PCP-ellenes antitest esetében a normális érték alsó határának az 50 mg/l-t,10 a Hib-ellenes antitest esetében a 0,15 mg/l-t tekintik.11 Vizsgálatunkban a 100 mg/l anti-PCP-antitest, ill. 0,75 mg/l alatti anti-Hib antitest titert12 is szuboptimálisnak véleményeztük, és az ez alatti titerrel rendelkező betegeket tesztimmunizációban részesítettük. A szuboptimális koncentrációt azért különböztettük meg a betegek esetében, hogy az oltással védetté tehessük őket ezen kórokozókkal szemben, de az eredmények értékeléséhez az alacsony antitestszintű betegek arányát hasonlítottuk a kontrollcsoporthoz.
A diphtheria- és a tetanus toxoid elleni antitest titerének meghatározása passzív hemagglutináció módszerével történt. A normális érték alsó határa 0,4 IE/l, amely már megfelelő védettséget biztosít a Di- és Te-toxoidokkal szemben.13
A 101, a vizsgált valamelyik kórokozóval szemben alacsony antitesttiterrel rendelkező diabeteszes gyermek közül 68-an estek át védőoltáson, közülük 3 gyermek pneumococcus és b típusú Haemophilus influenzae elleni védőoltásban is részesült. Csak Pneumovax23 vakcinációra 64 esetben, míg ActHib védőoltásra 1 gyermek esetében került sor. További 10 gyermek nem egyezett bele a védőoltásba, a többiekkel pedig megszakadt a kapcsolat ebben a tekintetben.
Statisztikai analízis
A különböző korcsoportba eső (5-10 éves és a 10 év feletti) 1TDM-ban szenvedő betegek és a kontrollcsoport eredményeit Student-féle t-próbával hasonlítottuk össze. Az eredményeket szignifikánsnak tekintettük, ha a p<0,05 volt. Korrelációanalízist lineáris regresszióval (Microsoft Excel) végeztünk.
Eredmények
A fertőzések gyakoriságára és súlyosságára vonatkozó retrospektív kérdőíves felmérésből - a betegek törvényes képviselőinek elmondása alapján - kiderült, hogy a vizsgált gyermekeknél nem jellemző a hosszan elhúzódó, vagy nehezen gyógyuló fertőzések nagy száma. A diabeteszes betegek általában egy hét alatt elmúló, könnyen gyógyuló felső légúti betegségekben, náthában, torokfájásban, mandulagyulladásban, hörgőgyulladásban szenvedtek, az előfordulási gyakoriságot tekintve évente 1-3 alkalommal. A gyermekek 18%-ának anamnézisében szerepelt évente 4-6 alkalommal ismétlődő, általában felső légúti infekció, ezen gyermekek 5%-ában ez hetekig tartó kezelést igényelt. Komolyabb alsó légúti vagy recidiváló felső légúti megbetegedés lezajlásáról 9,4%-ban számoltak be.
A diabeteszes gyermekek HbA1c átlagos (+/-2SD) értékeire vonatkozó adatok a következők voltak: oltás előtt 9,09+/-2,03%, oltás után 8,79+/-1,68%.
Az alap antitestszintekre vonatkozó eredmények szerint a vizsgálatban részt vevő 129 gyermek közül 28-ban (22,5%) mind a négy kórokozóval (pneumococcus és b típusú Haemophilus influenzae capsularis poliszacharid antigén, valamint diphtheria- és tetanus toxoid) szemben normális antitestkoncentrációkat mértünk. Százegy gyermeknél (77,5%) találtunk alacsony antitestkoncentrációt egy, ill. több kórokozóval szemben.
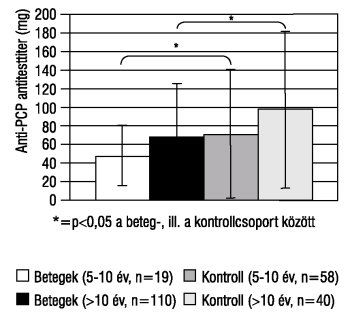
Az anti-PCP antitest titer átlaga az 1TDM-ban szenvedő gyermekek 5-10 éves korcsoportjánál 47,39 mg/l-nek (tartomány: 0,49 - >9 mg/l), a 10 évnél idősebbeknél 67,08 mg/l-nek (tartomány: 6 - >270 mg/l) bizonyult. A kontrollcsoportba tartozó 98 (5-19 éves) gyermekben a pneumococcus capsularis poliszacharid antigén elleni antitest szintje az 5-10 éves korcsoportban 70,86 mg/l (tartomány: 5,7 - >270 mg/l), a >10 évesekben pedig 96,70 mg/l (tartomány: 5,7 - >270 mg/l). Mindkét korosztályt illetően szignifikáns különbség volt kimutatható a beteg- és a kontrollcsoport értékei között (5-10 évesek: p=0,0358; >10 évesek: p=0,0237). A betegcsoport 5-10 éves korosztályában a gyermekek 63%-a, míg a 10 év felettieknél 48%-a alacsony, azaz 50 mg/l alatti anti-PCP antitesttel rendelkezik. A kontrollcsoportban - szemben az 1TDM-ban szenvedő betegekkel - a gyermekek több mint 50%-a rendelkezett 50 mg/l feletti antitesttiterrel (az 5-10 éves korosztályban 52%, a >10 évesek esetében 58%, 1. ábra).

1. ábra. Az 1-es típusú diabetes mellitusban szenvedő gyermekek pneumococcus capsularis poliszacharid ellenes (anti-PCP) szérum antitestkoncentrációi
A HbA1c-értékek és a PCP-AT-értékek közötti korrelációt vizsgálva pozitív összefüggést kaptunk (r=+0,036).
A Hib capsularis poliszacharid antigén elleni antitest átlagos koncentrációja a diabeteszes gyermekek 5-10 éves korosztályában 3,81 mg/l (tartomány: 0,49 - >9 mg/l), a 10 évnél idősebbeknél 2,43 mg/l (tartomány: 0,02 - >9 mg/l). E csoportba tartozóknál volt, aki már részesült ActHib oltásban, melyre a kötelező védőoltás keretében került sor (1 gyermek 1994-ben, 7 gyermek 1995-ben, 1-1 gyermek 1996-, 1997-, ill. 1998-ban). A kontrollcsoportban 98 gyermekben határoztuk meg a b típusú Haemophilus influenzae capsularis poliszacharid antigén elleni antitest szintjét. Az anti-Hib antitest-koncentrációjának átlaga a kontrollcsoportban, az 5-10 éveseknél 4,19 mg/l (tartomány: 0,19 - >9 mg/l), míg a >10 éveseknél 4,94 mg/l volt (tartomány: 0,27 - >9 mg/l). Szignifikáns különbség ugyan kimutatható volt a betegcsoport és a kontrollcsoport között (5-10 évesek: p=0,38; >10 évesek: p<0,001), azonban mindkét titerátlag kitűnő védettséget jelent a gyermekek számára. A diabeteszes gyermekek 8,5%-ának szérumában mértünk szuboptimális (0,75 mg/l alatti) anti-Hib antitest-koncentrációt (az 5-10 éves korosztályban 7%, a 10 év felettiekben 9%). A kontrollcsoportban hasonló megoszlást tapasztaltunk az anti-Hib antitest-koncentrációját illetően az egyes korcsoportokban, az 5-10 éves korosztályban 13%-nál, a 10 év felettiek esetében a gyermekek 16%-nál találtunk szuboptimális antitestszintet (2. ábra).
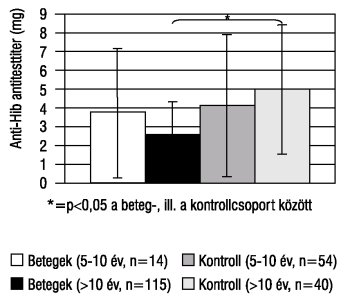
2. ábra. Az 1-es típusú diabetes mellitusban szenvedő gyermekek b típusú Haemophilus influenzae capsularis poliszacharid ellenes (anti-Hib) szérum antitest-koncentrációi
A HbA1c-értékek és a Hib-AT-titerek közötti korrelációt vizsgálva negatív összefüggést kaptunk (r= -0,012).
A diphtheria toxoid elleni antitesttiter átlaga a diabeteszes gyermekek esetében az 5-10 éveseknél 5,67 IE/l (tartomány: 0,125-16 IE/l), míg a 10 éven felülieknél 3,09 IE/l (tartomány: 0,03-32 IE/l). A gyermekek 90,7%-a megfelelő mennyiségű, kielégítő védettséget nyújtó antitesttel rendelkezik. A betegek 9,2%-ának szérumában szuboptimális, tehát 0,5 IE/l alatti antitestmennyiséget mértünk, korcsoporttól függetlenül (3. ábra).
A tetanus toxoid ellen termelt antitesttiter átlaga a diabeteszes gyermekek esetében az 5-10 éveseknél 11,63 IE/l (tartomány: 2-32 IE/l), míg a >10 éveseknél 8,6 IE/l (tartomány: 0,05 - 32 IE/l). Az 1TDM-ban szenvedő gyermekek 97,7%-ban kielégítő antitestmennyiséget érnek el és csak 2,3% rendelkezik 0,5 IE/l alatti szérum Te-AT szinttel (3. ábra).
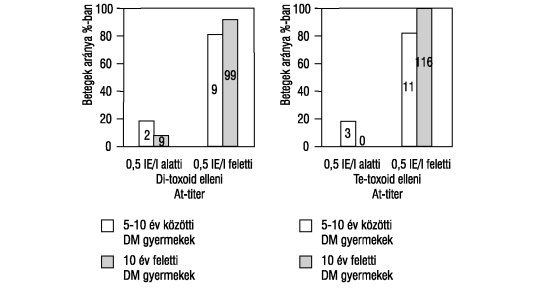
3. ábra. Az 1-es típusú diabetes mellitusban szenvedő gyermekek diphteria (Di) és tetanus (Te) toxoid ellenes szérum antitest-koncentrációi
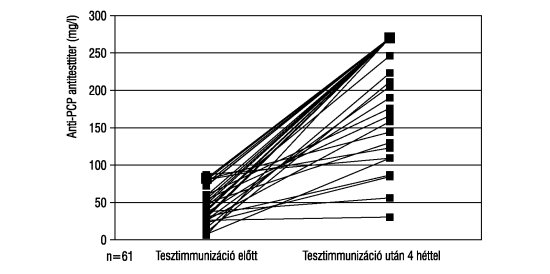
4. ábra. Pneumovax23 védőoltásban részesültek eredményei
A 67 szuboptimális (ezen belül 65 betegnél <50 mg/l) anti-PCP antitest szinttel rendelkező diabeteszes gyermek Pneumovax23 védőoltásban részesült. Az antitesttiternek az oltás után 4 héttel vizsgált emelkedése alapján az I. csoportba 37 gyermeket soroltunk (>10-szeres emelkedés), 16 páciens a II. csoportba került (>3-szoros emelkedés). A III. csoportba 14-en tartoznak, akik nem tudtak megfelelő mennyiségben ellenanyagot termelni (4. ábra).
A fertőzés gyakoriságát tekintve azonban azok a gyermekek, akik nem voltak képesek legalább háromszoros mennyiségű antitest termelésére, nem voltak - kettő kivételével - az átlagosnál betegesebbek. Az ActHib védőoltásban részesült 4 gyermek közül mindannyian megfelelő, azaz >3-szoros antitest termelésre voltak képesek. További 10, alacsony szintű anti-Hib antitesttel rendelkező gyermek védőoltásába nem egyeztek bele.
A Corynebacterium diphtheriae és a Clostridium tetani törzsek elleni immunizálásra 4 gyermeknek lenne szüksége DiTe vakcinával, közülük 1 a közeljövőben fogja megkapni a védőoltási programnak megfelelően a kötelező DiTe védőoltást.
Megbeszélés
A specifikus antitesttermelő képességet védőoltásra adott immunválasszal jellemezhetjük. A baktériumokkal szembeni védőoltásoknak nemcsak a humorális, hanem a sejt-közvetített immunválaszra is van hatása.14,15,16,17 A hymus-independens és a thymus-dependens antigének immunglobulinszekréciót és immunglobulin osztályváltást idéznek elő. Azonban az antigénre adott válasz szabályozása különbözőképpen történik. A thymus-dependens (protein vagy proteinnel konjugált poliszacharid) antigénre adott antitestválaszhoz antigénspecifikus T-lymphocyta segítségre van szükség, míg a thymus-independens (poliszacharid) antigének T-lymphocyta-mentesített egerekben is képesek stimulálni az antitesttermelést. A thymus-independens antigének két alosztályra oszthatók: 1-es típusú alosztályú antigének nem lépnek kapcsolatba a T-lymphocytákkal, a 2-es típusú (pneumococcus poliszacharid) antigéneknek van némi kapcsolata a T-lymphocytákkal.17,18 Diabeteszes betegek védőoltásra adott immunválaszával kapcsolatban azonban alig állnak rendelkezésre irodalmi adatok. Ismeretes az, hogy praediabetesben tetanus toxoid vakcináció hatására csökkent az IL-4-függő antitesttermelés.19
Vizsgálatunkkal annak felderítése volt a cél, hogy az 1TDM-ban szenvedő gyermekek képesek-e kielégítő mértékű specifikus antitest termelésére a protein és poliszacharid természetű antigénekkel szemben. A vizsgálat során meghatároztuk továbbá a betegek azon csoportját, akik a Streptococcus pneumoniae-val és a b típusú Haemophilus influenzae-vel szembeni immunizáció révén védetté tehetők abban a reményben, hogy az ezirányú fertőzések számát és a gyógyszeres kezelés szükségességét tovább tudjuk majd csökkenteni. Ugyan a diabeteszes betegek között nem gyakoribbak az infekciók, azonban ha egy diabeteszes gyermeknél bármilyen gyulladásos jellegű megbetegedés tüneteit észleljük - még ha enyhe, hurutos betegségnek tűnik is -, mindig számíthatunk a cukoranyagcsere felborulására, az inzulinigény változására, de akár súlyos kimenetelű infekcióhoz is vezethet a megbetegedés.20
Anamnesztikus adataink alapján az 1TDM-ban szenvedő betegek többsége, azaz 73%-a, évente 1-3 alkalommal esik át légúti fertőzésen, és kortársaikhoz hasonlóan általában egy hét alatt rendeződik állapotuk. A betegségek gyakoribb előfordulása a kisgyermekkor és az iskoláskor kezdeti szakaszára jellemző, hasonlóan az átlagpopulációban kimutatható előfordulási gyakorisághoz.21
A diphtheria toxoid elleni antitest meghatározásával jellemzett protein antigén elleni antitest termelő képesség betegeink 90,7, ill. 97,7%-ánál - a kötelező védőoltások következtében - megfelelő (0,5 IE/l feletti). Mindezek alapján azt a következtetést vonhatjuk le, hogy az 1TDM-ban szenvedő gyermekek protein antigének elleni humorális immunitásában nem észlelhető eltérés, és a kötelező DiPerTe oltás megfelelő védettséget biztosít számukra. A DiTe-ellenes antitest mennyisége azonban - nem diabetesre specifikusan, az oltási időponttól egyre távolodva - az életkorral csökken, ami felveti a gyermekek rendszeres újraoltásának szükségességét.
A poliszacharid antigének elleni immunitást kétféle paraméterrel jellemeztük: a b típusú Haemophilus influenzae és a pneumococcus capsularis poliszacharid antigén elleni antitest termelésével. A Hib capsularis poliszacharid antigén elleni antitest vonatkozásában a diabeteszes gyermekek túlnyomó többsége a megelőzésre adott vakcináció következtében jelentős nagyságú ellenanyagtiterrel rendelkezett. A Hib-ellenes oltás kötelezővé tételével az 1TDM-ban szenvedő gyermekekben a Hib elleni antitest mennyisége vélhetően megbízható védettséget jelentő tartományban fog maradni. Eredményeink ugyanis alátámasztják azt, hogy azok a betegek, akik korábban nem részesültek Hib elleni védőoltásban és antitestszintjük 0,75 mg/l alatti volt, kivétel nélkül >3-szoros titeremelkedéssel válaszoltak az ActHib immunizációra. Ebben a védőoltásban a poliszacharid fehérjével konjugált, ezért thymusdependens immunválaszt indukál. Mindebből az a következtetés is levonható, hogy az 1TDM-ban szenvedő gyermekek poliszacharid antigénre adott thymus-dependens immunválasza nem károsodott.
A pneumococcus elleni védőoltásban nem részesült gyermekek szérumában kialakuló anti-PCP antitesttitere a korábban lezajlott fertőzésekből és az erre kialakult immunválaszból adódik. A pneumococcus-fertőzés a felnőtt népességben relatíve gyakori, egy svéd tanulmány szerint 6,22míg egy pittsburghi statisztika szerint 13%-os.23
Ennek ellenére betegeink szérumában az anti-PCP antitest titerei alacsonynak bizonyultak: az 5-10 év közötti korosztályban 11 esetben <50mg/l, 4 gyermekben 50-100mg/l és csak 2-nél optimális, >100mg/l. Betegeink többsége a 10 év feletti korcsoportba tartozik. Az anti-PCP antitesttiterét 53 gyermekben <50 mg/l-nek, 33 esetben 50-100 mg/l közöttinek, míg 27 esetben >100 mg/l felettinek mértük. Adataink szerint a pneumococcus capsularis poliszacharid antigén elleni antitest titerértékeinek átlaga az életkor előrehaladtával nő, feltehetően azért, mert a gyermekek egyre több pneumococcus-fertőzésen esnek át.
Az anti-PCP antitest alacsony titerével rendelkező betegeket a 23 leggyakoribb pneumococcus törzs capsularis poliszacharid antigénjével védőoltásban részesítettük. Az oltás után 4 héttel a betegek 79 százalékánál legalább 3-10-szeres titeremelkedés volt tapasztalható, ezen belül 55 százalékukban több mint 10-szeres titeremelkedést találtunk. A betegek többsége tehát védetté tehető a pneumococcus törzsekkel szemben. A tesztimmunizáció után a betegek viszonylag nagy hányadánál (21%) azonban nem, vagy csak kismértékben észleltünk megfelelő antitestválaszt, ami ezen gyermekekben a poliszacharid-ellenes antitest termelő képesség zavarára utal. Ugyanakkor ezeknél a betegeknél nem tapasztaltunk retrospektív felmérésünk során nagyobb infekciós gyakoriságot, azonban a klinikai nyomon követés kapcsán a betegek súlyosabb fertőzése esetén ez a lelet terápiás tervünk kialakítása szempontjából jelentőséggel bírhat. Az anti-PCP antitest diabeteszesekben észlelt alacsonyabb koncentrációja feltételezésünk szerint ezen betegcsoport poliszacharid antigénekkel szembeni zavart immunválaszának tudható be. Az antitesttermelő képesség csökkenése feltehetően nem a hyperglykaemia következménye, mivel az anti-PCP antitest koncentrációja és a HbA1c szintje között nem találtunk fordított összefüggést. A jelenség hátterében megváltozott sejt-közvetített immunválasz, ezen belül a citokintermelés egyensúlyának felborulása szerepelhet, melynek vizsgálata munkacsoportunk részéről folyamatban van. Hasonló adatokról számolnak be rheumatoid arthritises betegek vizsgálata során.24
Eredményeink alapján úgy véljük, hogy ezen veszélyeztetett diabeteszes populáció rendszeres (5 évenkénti) immunizálása kívánatos lenne a hazai és külföldi ajánlásokkal összhangban annak érdekében, hogy az infekciók száma és súlyossága csökkenthető legyen.25,26 Az oltásra nem jól reagáló betegek esetében konjugált pneumococcus védőoltás bevezetése eredményezheti a betegek megfelelő védettségének kialakítását.27
Irodalom
1. Johnston, CLW: Infection and diabetes mellitus. (in: Pickup, JC, Williams G [eds]: Textbook of diabetes. Blackwell Science Ltd Oxford, 1997.) pp. 70.1-70.14
2. Sensi, M, Pozzili, P, Gorsuch, AN, Bottazzo, GF, Cudworth, AG: Increased killer cell activity in insulin dependent (type 1) diabetes mellitus. Diabetologia 20: 106-109, 1981.
3. Sandberg, ET: Immunodeficiencies in hereditary and metabolic diseases. (in: Rich, RR [ed]: Clinical immunology. San Louis, Baltimore, Boston, 1996.) pp. 803-833.
4. Wahn, U: Evaluation of the child with suspected primary immunodeficiency. Pediatr Allergy Immunol 6: 71-79, 1995.
5. Schiffmann, G: Response to pneumococcal vaccine: Pediatrics 88: 1074-75, 1982.
6. Boctor, FN, Barka, NE, Agopian, MS: Quantitation of IgG antibody to Streptococcus pneumoniae vaccine by ELISA and FAST-ELISA using tyraminated antigen. J Immunol Methods 120: 167-171, 1989.
7. Gray, BM: ELISA methodology for polysaccharide antigens: protein coupling of polysaccharide for adsorption to plastic tubes. J Immunol Methods 28: 187-192, 1979.
8. Antilla, M, Eskola, J, Ahman, H, Käythy, H: Differences in the avidity of antibodies evoked by four different pneumococcal conjugate vaccines in early childhood. Vaccine 17: 1970-1977, 1999.
9. Barra, A, Schulz, D, Aucounturier, P, Preud'homme, JL: Measurement of anti-Haemophilus infuenzae type b capsular polysaccharide antibodies by ELISA. J Immunol Methods 115: 111-117, 1988.
10. Musher, DM, Luchi, MJ, Watson, DA, Hamilton, R, Baughn, RE: Pneumococcal polysaccharide vaccine in young adults and older bronchitics: determination of IgG responses by ELISA and the effect of absorption of serum with non-type specific cell wall polysaccharide. J Infect Dis 161: 728-735, 1990.
11. Robbins, JB, Parke, JC, Schneerson, R, Whisnant, JK: Quantitative measurement of 'natural' and immunizationinduced Haemophilus influenzae type b capsular polysaccharide antibodies. Pediatr Res 7: 103-110, 1973.
12. Peltola, H, Käythy, H, Virtanen, M, Makela, PH: Prevention of Haemophilus influenzae type b bacteremic infections with the capsular polysaccharide vaccine. N Engl J Med 310. 1561-1566, 1984.
13. Nyerges G: Infektológia. (In: Maródi L [szerk]: Gyermekgyógyászat. Medicina, Budapest, 1998.) pp. 301-344,
14. Wuorimaa, T, Kaythy, H, Eskola, J, Bloigu, A, Leroy, O, Surcel, HM: Activation of cell-mediated immunity following immunization with pneumococcal conjugate or polysaccharide vaccine. Scand J Immunol 53: 422-428, 2001.
15. Buchanon, RM, Briles, DE, Arulanandam, BP, Westernick, MA, Raeder, RH, Metzger, DW: IL-12-mediated increases in protection elicited by pneumococcal and meningococcal conjugate vaccines. Vaccine 19: 2020-2028, 2001.
16. Winter WE, Maclaren NK: Autoimmune Endocrinopathies. (In: Stiehm, ER [ed]: Immunologic disorders in infants & children. Saunders, Los Angeles, California, 1996.) pp. 824-854
17. Leiva, LE, Butler, B, Hempe, J, Ortigas, AP, Sorensen, RU: Up-regulation of CD40 ligand and induction of a Th2 response in children immunized with pneumococcal polysaccharide vaccines. Clin Diagn Lab Immunol 8: 233-240, 2001.
18. Breukels, MA, Rijkers, GT, Voorhorst-Ogink, MM, Zegers, BJ: Regulatory T cells in the antibody response to Haemophilus influenzae type b polysaccharide. Infect Immunol 67: 789-793, 1999.
19. Schmid, S, Molteni, A, Füchtenbush, M, Naserke, HE, Ziegler, A-G, Bonifacio, E: Reduced IL-4 associated antibody responses to vaccine in early pre-diabetes. Diabetologia 45: 677-685, 2002.
20. Monto, AS, Cavallaro, JJ: The Tecumseh study of respiratory illness. II. Patterns of occurrence of infection with respiratory pathogen. Am J Epidemol 94: 280-89, 1971.
21. Monár M: Fertőzések halmozódása juvenilis diabetesben (pneumococcus peritonitisben szenvedő diabeteses fiú esetének ismertetése). Gyermekgyógyászat 26: 322-24, 1975
22. Burman, LA, Norrby, R, Trollfors, B: Invasive pneumococcal infections: incidence, predisposing factors, and prognosis. Rev Infect Dis 7: 133-142, 1985.
23. Fang, GD, Fine, M, Orloff, J, Arisumi, D, Yo VL, Kapoor, W, Grayston, JT, Wang, SP, Kohler, R, Muder, RR: New and emerging etiologies for community-acquired pneumonia with implications for therapy: a prospective multicenter study of 359 cases. Medicine 69: 307-316, 1990.
24. Snowden, N, Moran, A, Booth, J, Haeney, MR, Swinson, DR: Defective antibody production in patients with rheumatoid arthritis and bronchiectasis. Clinical Rheumatology 18: 132-135, 1999.
25. A "Johan Béla" Országos Epidemiológiai Központ módszertani levele a 2002. évi védőoltásokról. Egészségügyi közlöny 52: 299-316, 2002.
26. Overturf, GD: American Academy of Pediatrics. Comittee on Infectious Diseases. Technical report: prevention of pneumococcal conjugate and polysaccharide vaccines and antibiotic prophylaxis. Pediatrics 106: 367-376, 2000.
27. Eskola, J, Kilpi, T, Palmu, A, Jokinen, J, Haapakoski, J, Herva, E, Takala, A, Kaythy, H, Karma, P, Kohberger, R, Siber, G, Makela, PH: Efficacy of a pneumococcal conjugate vaccine against acute otitis media. N Engl J Med 344: 403-409, 2001.
- Közlésre érkezett: 2002. július 30.
- Közlésre elfogadva: 2002. október 19.
- A szerző levelezési címe: Dr. Kalmár Ágnes
- Fővárosi Önkormányzat Budai Gyermekkórház
- 1023 Budapest, Bolyai u. 5-7.