MTA Kísérleti Orvostudományi Kutatóintézet, Budapest
AZ ENDOCRIN ÉS AZ EXOCRIN PANCREASKAPCSOLATA
Varga Gábor dr.
Összefoglalás
Az emlősök hasnyálmirigye közismert módon mintegy 90 százalékban külső elválasztású feladatot ellátó acinusokból és ductusokból és mintegy 2 százalékban belső elválasztású szigetsejtekből áll, míg a fennmaradó 8 százalékot a kötőszövet és a vérerek adják. Az endocrin és exocrin sejtek közös eredetűek: mind a szigetsejtek, mind a ductusok, mind az acinusok egy homogén őssejt-populációból származnak. Bár a folyamat szabályozásának nem minden elemét ismerjük, a legújabb kutatások nyilvánvalóvá tették, hogy a különböző hasnyálmirigysejt-típusok kialakulása jól köthető bizonyos transzkripciós faktorok aktiválódásához. Az endocrin pancreas szerepe az exocrin működés szabályozásában közismert. Az inzulin a szénhidrátbontó amiláz génexpressziójának szabályozásában döntő szerepet játszik, s emellett kimutatták a pancreas enzimszekrécióját potencírozó hatását is kolecisztokinin-stimuláció során. A szomatosztatin, a glukagon és a pancreaspolipeptid ugyanakkor gátolják az exocrin szekréciót, illetve az acinussejtek fehérjeszintézisét. Kevésbé tisztázott az exocrin hasnyálmirigy élettani hatása az endocrin mirigyállományra. Patológiás körülmények között azonban gyakran megfigyelhetjük a külső elválasztású mirigyállomány idült károsodását követően a belső elválasztású működés zavarát, elsősorban krónikus pancreatitisben, illetve a hasnyálmirigy adenocarcinomája során. Napjainkban a tudományterület egyik legizgalmasabb kihívása azon a megfigyelésen alapul, hogy bizonyos körülmények között létrejöhet az exocrin hasnyálmirigysejtek transzdifferenciációja, azaz a külső elválasztású sejtekből funkcionálisan aktív szigetsejtek, így béta-sejtek válhatnak felnőttkorban is. A diabetes mellitus gyógyításának megoldásában számos más sejtmanipulációs megoldás is kínálkozik, így egyebek mellett a klónozás, illetve pluripotens őssejtek megfelelő kezelésével inzulintermelő sejtek létrehozása. Ugyanakkor mind etikai, mind szakmai szempontból a fenti technikák közül a ductus-sejtek transzdifferenciációjával létrehozott inzulintermelő sejtek alkalmazása tűnik a legígéretesebbnek.
Kulcsszavak: exocrin pancreas, endocrin pancreas, egyedfejlődés, transzdifferenciáció
Relationship between the endocrine and the exocrine parts of the pancreas
Summary
The mammalian pancreas is made up of about 90 percent exocrine acini and ducts and 2 percent endocrine islets, while the remaining 8 percent is connective tissue and blood vessels. The endocrine and exocrine cells are from common origin: both islets, ducts and acini derive from a homogenous stem cell population. Although not all steps of the development are known, recent studies provided evidence that the formation of the different differentiated cell populations depend on the activation of certain transcription factors. The regulatory function of the endocrine part on the exocrine gland is well established. Insulin plays a central role in controlling the gene expression of the carbohydrate digesting amylase, and also potenciate the secretory action of cholecystokinin. On the other hand, somatostatin, glucagon and pancreatic polypeptide both inhibit exocrine secretion and acinar protein synthesis. The physiological effect of the exocrine tissue on the endocrine function is less clear. But, under pathological conditions such as during chronic pancreatitis or pancreatic adenocarcinoma, a disturbed endocrine function can also be observed. One of the greatest challenges of our scientific community today is based on the observation that exocrine cells may transdifferentiate and become functionally active beta-cells even in the adult tissue. There are a number of attractive putative methods to cure diabetes mellitus, such as cell cloning and also transformation of pluripotent stem cells into insulin-producing cells. But the use of insulin-producing cells transdifferentiated from normal ductal cells is one of the most promising and ethically well accepted procedure among these.
Keywords: exocrine pancreas, endocrine pancreas, development, transdifferentiation
A hasnyálmirigy anatómiai felépítése, vérellátása és beidegzése
Az exocrin és endocrin feladatokat egyaránt ellátó hasnyálmirigy egy elnyújtott, lapos, 15-20 cm hosszú, körülbelül 100 g tömegű szerv. A hasüreg hátsó falánál, a gyomor mögött fut haránt irányban. A mirigy feji vége a legszélesebb, kötőszövetesen összenőtt a duodenummal, s nagyrészt befedi annak felületét. A fej ferdén felfelé az aorta előtt fekvő pancreastestben folytatódik, amely a kiscseplesszel érintkezik. A test bal felé és felfelé haladva megy át éles határ nélkül a farokba. A farok a lép hilusánál lekerekítetten végződik. A pancreas alakjában és elhelyezkedésében pancreatográfiával kisebb variációk figyelhetők meg. Így az esetek mintegy 60 százalékában a pancreasfej a gerincoszloptól jobbra helyezkedik el, 35 százalékában éppen a gerinc vonalában látható, míg 5 százalékában a gerincoszloptól balra figyelhető meg.1
A pancreas fő kivezető csöve (ductus Wirsungianus) a mirigy farki végénél kisebb vezetékek összefolyásával kezdődik, s végigfutva a hasnyálmirigyen a Vater-papillánál éri el a duodenumot, csakúgy, mint általában az epevezeték is. Az esetek mintegy 20 százalékában ugyanakkor a fő pancreasvezeték és az epevezeték egymástól függetlenül éri el a duodenumot. A másodlagos pancreasvezeték (ductus Santorini) a pancreasfejben anasztomizál a fő kivezető csővel, majd körülbelül 2 cm-rel a Vater-papilla fölött nyílik a duodenumba.
A hasnyálmirigy vérellátása az a. coeliacából és az a. mesenterica superiorból érkezik. Ezek az erek a pancreas mellett más szervek ellátásában is szerepet játszanak. A mirigy vérellátását alapvetően a számos helyen megfigyelhető anastomosis jellemzi. Az a. coeliaca elágazásai a baloldali a. gastrica, az a. lienalis és az a. hepatica communis. Utóbbiból származik az a. gastroduodenalis. Ez az artéria elágazva adja az a. pancreaticoduodenalis posterior superiort, az a. gastroepiploicát és az a. pancreaticoduodenalis anterior superiort. Az a. mesenterica superior közvetlenül a pancreas mögött ered az aortából. Ágai közül az a. pancreaticoduodenalis posterior inferior és az a. pancreaticoduodenalis anterior inferior a legfontosabbak. Ezek az artériák a pancreasban anastomizálnak az a. coeliaca-ból eredő megfelelő párjaikkal. Az a. lienalis számos kisebb ágat küld a pancreashoz. A hasnyálmirigy vénás keringése az artériás ellátáshoz hasonló. A pancreas kisebb vénái a vért számos anastomosist képezve a v. lienalison és a v. mesenterica superioron keresztül juttatják a máj portalis rendszerébe. A pancreas jelentős nyirokérhálózattal is rendelkezik. A nyirokerek az artériák mellett futnak.
A pancreas egyaránt kap szimpatikus és paraszimpatikus ágakat az autonóm idegrendszerből. A paraszimpatikus innerváció, amelyet a n. vagus szolgáltat, alapvető fontosságú a szekréciós működés stimulációjában. Az efferens vagalis idegek sejttestei a X. agyideg dorsalis motoros nucleusában helyezkednek el. A n. vagusban lefutó rostok áthaladnak a gl. coeliacumon, de ott nem kapcsolódnak át. Az átkapcsolódás az intrapancreaticus ganglionokban történik, így a postganglionaris sejtek testei is a mirigyen belül helyezkednek el. Az érzőidegek ugyancsak átfutnak a gl. coeliacumon, sejttesteik a nucleus ambiguusban találhatók. A szimpatikus innerváció praeganglionaris rostjai az ötödik és tizedik thoracalis gerincvelői szegmensek közötti területen erednek. A gl. coeliacumban képeznek szinapszist a postganglionaris idegekkel. Innen a pancreast ellátó artériák mellett futva érik el a mirigyet.
Az idegvégződések a vérerek, az acinus-sejtek, a ductus-sejtek és a szigetsejtek működésének szabályozásában egyaránt fontosak. A klasszikus kolinerg és adrenerg neuronok mellett számos peptiderg, illetve egyéb neurotranszmittereket tartalmazó idegek is kimutathatók a pancreasban. Immuncitokémiai módszerekkel számos neuropeptidet azonosítottak az idegrostokban, illetve a sejttestekben. Ezek közé tartozik a vasoactiv intestinalis polipeptid (VIP), a P anyag, a gastrinreleasing peptid (GRP), a galanin, a neuropeptid Y és a calcitonin-gene-related peptid (CGRP). Ezek a peptidek, az acetilkolin és a katekolaminok mellett, minden bizonnyal szerepet játszanak a szekréciós működés, illetve a pancreas vérellátásának szabályozásában.
A hasnyálmirigy finomszerkezete
A pancreas szövet 80 százalékát az acinus parenchyma, 10 százalékát a kivezetőcső-rendszer, s mintegy 2 százalékát az endocrin sejtek szigetei alkotják, míg a fennmaradó néhány százalékot a vér és nyirokerek, az idegek és különféle kötőszöveti elemek teszik ki. Az emésztőenzimeket termelő piramis alakú hámsejtek, az acinus-sejtek építik fel az emésztőenzim-termelés funkcionális és morfológiai alapegységeit, az acinusokat. Az acinus-sejtek sejtmagjai a sejtek közepén helyezkednek el, a durva felszínű endoplasmaticus reticulumban (RER) rendkívül gazdag basalis területük bazofil festődésű. Az acinus-sejtek csúcsi része nagy mennyiségben tartalmazza az emésztőenzimeket raktározó zimogén granulumokat. Ez a terület acidofilen festődik. Az egymás mellett egy rétegben szorosan elhelyezkedő és szoros kapcsolattal (zonula occludens, tight junction) illeszkedő sejtek alakítják ki a végkamrát, az acinust. Az acinusok alakja kerek vagy enyhén ovális. Az acinaris végkamrákba a ductusba történő átmenetnél betüremkednek az úgynevezett centroacinaris sejtek, amelyek nem termelnek exportfehérjéket, s szerkezetüket tekintve valójában ductus-sejtek.1
A pancreas kivezetőcső-rendszere intercalaris, intra- és interlobularis ductusokra és a fő vezetékekre osztható. Az intercalaris ductusok (ductulusok) és az intralobularis ductusok egy rétegben elhelyezkedő köbös hámsejtjei nemcsak az acinussejtek által termelt enzimek szállítását végzik, de jelentős mennyiségű, bikarbonátban gazdag nedvet is termelnek. Míg az acinus-sejtek luminalis felszínén nagyszámú mikrovillust figyelhetünk meg, addig ezeknek a ductusoknak a felszíne sima. A sejtek citoplazmája nagy mennyiségű mitokondriumot tartalmaz, amelyek a Golgi-komplexek körül koncentrálódnak. Durva felszínű endoplasmaticus reticulumban igen szegények, különösen, ha az acinus-sejtekhez hasonlítjuk ezeket a hámsejteket. Az interlobularis ductusok falát piramis alakú epithelialis sejtek képezik, luminalis felszínüket rövid mikrovillusok borítják. A sejtek citoplasmáját durva felszínű endoplasmaticus reticulum és mitokondrium tölti ki, s nagy mennyiségben tartalmaznak szekréciós granulumokat. Bár az interlobularis ductusok hámsejtjeinek szekréciós aktivitása messze nem olyan jól ismert, mint az acinus-sejteké, annyi bizonyos, hogy ezek a sejtek mucoproteineket termelnek, amelyeknek a kivezetőcső hámjának védelmében lehet szerepe. A fő kivezetőcsövek fala az interlobularis ductusok hámjához nagyon hasonló szerkezetű.
Az exocrin parenchymában elszórtan helyezkednek el az átlagosan 200 mm átmérőjű Langerhans- szigetek, s bennük a peptidhormonokat termelő endocrin sejtek. Minden egyes peptidhormon más sejttípusban termelődik, amelyek jól elkülöníthetőek. Az inzulint előállító, centrálisan elhelyezkedő béta-sejtek képezik a szigetsejtek mintegy 75 százalékát. A glukagont a béta-sejteket körülvevő, s a szigetsejtek 20 százalékát képező alfa-sejtek szintetizálják. Hematoxilin-eozin festéssel az előbbiek világosabbak, míg az utóbbiak sötétebb festődésűek. Emellett kisebb számban szomatosztatint, illetve pancreas-polipeptidet termelő sejtek is azonosíthatók a szigetekben. A szomatosztatint a delta-sejtek, a pancreas-polipeptidet a PP-sejtek termelik.
A hasnyálmirigy kialakulása az egyedfejlődés során
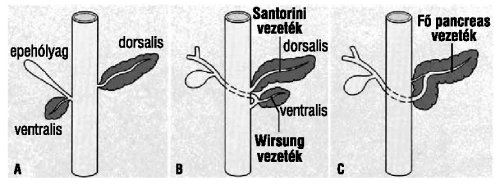
Az egyedfejlődés során a pancreas két duodenalis primordiumból fejlődik, amelyek emberben a gestatio negyedik hetében figyelhetők meg először (1. ábra). A dorsalis primordium gyorsabban fejlődik. A ventralis primordiumból alakul ki az epehólyag és az epevezetékek. A növekedés során a két rész egyre közelebb kerül egymáshoz, majd a gestatio hetedik hetében összeolvadnak. A ventralis és dorsalis ductusok fúziója során alakul ki a pancreas fő kivezetőcsöve (ductus Wirsungianus), míg a dorsalis pancreas proximalis vége alakul másodlagos pancreasvezetékké (ductus Santorini).1
Az endocrin és exocrin sejtek közös eredetűek: mind a szigetsejtek, mind a ductusok, mind az acinusok egy homogén őssejt-populációból származnak. A ductularis epitheliumkezdemény (nesidioblastoma) pluripotens őssejtjeiből fejlődnek. Kezdetben primitív ductulusok alakulnak ki.

1. ábra. A hasnyálmirigy kialakulása a két duodenalis primordiumból
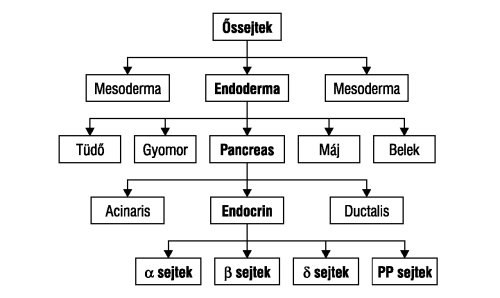
2. ábra. A hasnyálmirigy különböző sejttípusainak kialakulása az egyedfejlődés során. A folyamat egyes lépései genetikusan meghatározottak, s természetes körülmények között visszafordíthatatlanok
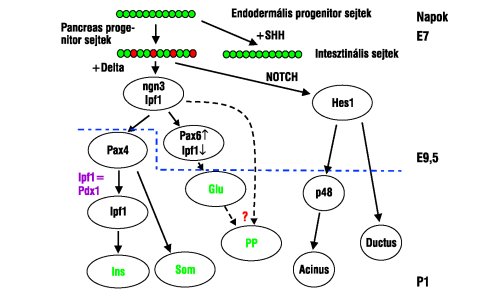
3. ábra. A pancreas különböző sejttípusainak kialakulásában szerepet játszó kulcsfontosságú gének feltételezett aktivációs sorrendje, s az ezzel párhuzamosan bekövetkező sejtdifferenciáció egérembrióban. Az E7 és az E9,5 az embrionális életkort jelentik napokban, míg a P1 az első postnatalis napra utal. További magyarázat a szövegben olvasható
Ezen ductulusok egyes sejtjei azután fokozott osztódásba kezdenek, elkülönülnek a vezeték kezdeményektől, s differenciálódásuk vezet az endocrin granulumokat tartalmazó, már felismerhető belső elválasztású sejtcsoportok megjelenéséhez a gestatio 12. hetében. Ezt követi a nem-endocrin acinussejtek és ductusok differenciálódása. Az exocrin pancreas teljes érési folyamata csak a születés után fejeződik be. Ezzel szemben az endocrin hasnyálmirigy morfológiai szempontból érettnek tekinthető a születés pillanatában.
Bár a folyamat szabályozásának nem minden elemét ismerjük,2 a legújabb kutatások nyilvánvalóvá tették, hogy a különböző hasnyálmirigy-sejttípusok kialakulása jól köthető bizonyos transzkripciós faktorok aktiválódásához (2. és 3. ábra). Így például a p48 gén fontos szerepet játszik az acinusok kialakulásában, ugyanakkor az endocrin sejtekben nem expresszálódik. A neurogenin-3 (ngn3) gén aktivációja ugyanakkor az endocrin differenciálódás korai markere.3
A 3. ábra összefoglalja azokat a fontosabb jelenleg feltételezett génaktivációs mechanizmusokat, amelyek az endocrin, acinaris és ductalis sejttípusok kialakulásához vezetnek. Az endodermalis progenitor sejtek nagyobb részében aktiválódik az úgynevezett sündisznó transzkripciós faktor (sonic hedgehog, SHH), s ezek a sejtek képezik a vékonybél hámsejtrétegét. A sejtek egy kisebb csoportjában a bélkezdemény dorsalis és ventralis oldalán egyaránt az SHH szignálmolekulák nem expresszálódnak, s ezek a sejtek differenciálódnak a pancreas progenitor sejtjeivé. A mirigy fő tömegét képező sejtekben a NOTCH szignalizáció aktiválódik. Ugyanakkor a belső elválasztásúvá differenciálódó sejtekben a NOTCH szignalizáció aktivációjának hiányában a 2 ngn3 gén expressziója fokozódik. Az ngn3 aktiváció szintje tehát az endocrin elkülönülés kulcslépése. Az endocrin sejttípusok nem egyszerre jelennek meg, legkorábban a glukagon-termelő sejtek figyelhetők meg, s ez összefüggésbe hozható az Ipf1/Pdx1 gén aktivációjának csökkenésével, valamint a Pax6 transzkripciós faktor megjelenésével ezekben a sejtekben. Pax4 és Hlxb9 deficiens egerekben végzett vizsgálatok alapján úgy tűnik, hogy az inzulint és a szomatosztatint termelő sejtek egy közös közbenső differenciáltságú sejttípusból alakulnak ki. Először a Pax4 transzkripciós faktor jelenik meg a progenitor sejtekben. A valamivel később expresszálódó Hlxb9 a béta-sejtek differenciálódásának irányába hat, míg a faktor hiányában a sejtek delta-sejtekké alakulnak. A béta-sejtekben ugyanakkor jelentősen megemelkedik és viszonylag magas szinten marad az Ipf1/Pdx1 gén expressziója. Az itt leírt folyamat alapelemeit egerekben végzett vizsgálatokkal tisztázták knockout (K.O.), azaz génkiütéses technológiát alkalmazva. Ez a módszer az ember hasnyálmirigyének vizsgálatára nem alkalmazható. Ugyanakkor az egyedfejlődés során ugyanezen gének expressziójának és a megjelenésük időbeni és térbeni eloszlásának tanulmányozásával nyert eredmények azt mutatják, hogy emberben a hasnyálmirigy egyes sejttípusainak kialakulásáért felelős gének azonosak az egerekben leírtakkal. Itt kell azonban kiemelnem, hogy a fent leírt génaktivációs rendszer nem foglalja magában az összes lehetséges, a normál felnőtt emberi pancreas kialakulásában szerepet játszó tényezőt, csupán annak néhány fontos, ismert elemét.2
Az exocrin és az endocrin hasnyálmirigy kölcsönhatása felnőtt emberben normál körülmények között, illetve patológiás elváltozások során
Az endocrin pancreas szerepe az exocrin működés szabályozásában közismert. A funkcionális kapcsolatot a strukturális kapcsolódás biztosítja: a sziget-acinus portalis rendszer révén az acinussejteket a felszabaduló hormonok a szisztémás koncentrációknál jelentősen magasabb szinten érik el. Az inzulin a szénhidrátbontó amiláz génexpressziójának szabályozásában döntő szerepet játszik, s emellett kimutatták a pancreas enzimszekrécióját potencírozó hatását is cholecisztokinin-stimuláció során. A szomatosztatin, a glukagon és a pancreas-polipeptid ugyanakkor gátolja az exocrin szekréciót, illetve az acinussejtek fehérjeszintézisét.
Kevésbé tisztázott az exocrin hasnyálmirigy élettani hatása az endocrin mirigyállományra. Patológiás körülmények között azonban gyakran megfigyelhetjük az külső elválasztású mirigyállomány idült károsodását követően a belső elválasztású működés zavarát, elsősorban krónikus pancreatitisben, illetve a hasnyálmirigy adenocarcinomája során.
Ez a kérdéskör önmagában több referátumot is kitöltene, azonban itt csak a legáltalánosabban ismert kölcsönhatások felvetésére szorítkoztam. úgy gondoltam, hogy ezt a terjedelmében szűkre szabott dolgozatot helyesebb a kevésbé közismert összefüggéseknek szentelni.
Transzdifferenciáció az exocrin és az endocrin sejtek között - álom vagy realitás?
Napjainkban a tudományterület egyik legizgalmasabb kihívása azon a megfigyelésen alapul, amely szerint bizonyos körülmények között létrejöhet az exocrin hasnyálmirigysejtek transzdifferenciációja, azaz a külső elválasztású sejtekből funkcionálisan aktív szigetsejtek, így béta-sejtek válhatnak felnőttkorban is.4
Ahhoz, hogy ez a kérdés egyáltalán felvetődjön, szükség volt a fentebb részletezett génkiütéses vizsgálatokra. Ezek a vizsgálatok világítottak rá arra, hogy az egyes exocrin és endocrin sejttípusok őssejtekből történő kialakulásában döntő szerepet játszik néhány gén. Ez felvetette, hogy ezen kulcsfontosságú gének aktivitásának akár genetikai, akár farmakológiai, akár egyéb módon történő megváltoztatásával lehetőség nyílhat az egyes, már differenciálódott sejtek őssejtekké, majd másfajta differenciálódott sejtekké alakításához. Alapvetően tehát a ductus-sejtek génexpreszsziós profiljának megváltoztatása, az exocrin működésre jellemző gének szuppresszálása, másfelől az endocrin sejtekre jellemző gének átíródásának fokozása a megoldandó feladat, amelyet in vitro körülmények között humán sejteken, illetve in vivo transzgénikus egerekkel végzett kísérletekben már részben megoldottak. A dolgozat terjedelme nem engedi meg, hogy részletesen beszámoljak azon sokirányú próbálkozásokról, amelyek ennek e kérdéskörnek a megoldására történnek napjainkban. Csupán néhány példát említenék annak érzékeltetésére, hogy ebben a tekintetben már rendkívül komoly előrehaladás történt.
A francia Gmyr és munkatársai5 szigetsejt-izolálásra és transzplantációra előkészített emberi donor pancreasból indultak ki, s azokat a sejteket használták fel, amelyek a mirigy szöveti állományának döntő többségét képezik, s amelyeket a korábban szigetsejt-izoláció során tulajdonképpen hulladékként kezeltek. Ezek a sejtek az exocrin acinus-sejtek, amelyeket Gmyr szövettenyészetben tartott, s ennek során figyelte a kiültetett acinussejtek acinaris, ductalis, illetve endocrin sejtekre jellemző génexpressziós markereinek változását. Rövidre fogva, azt tapasztalta, hogy az emberi acinus-sejtek a kultúrában elvesztik acinaris markereiket (pl. nem termelnek emésztőenzimeket), s mind morfológiailag, mind expreszsziós markereiket tekintve ductalis jelleget öltenek. A sejteket tovább tenyésztve ezekben a kevéssé differenciált ductalis jellegű sejtekben megjelenik az Ipf1/Pdx1 gén fehérjeterméke, amely pedig a béta-sejtekre jellemző. Ugyanakkor ebben a vizsgálatsorozatban még nem sikerült elérni, hogy ezek a sejtek inzulint is termeljenek.5
Egér pancreasductusokat tenyésztve azonban Ramiya és munkatársai6 ezt a problémát is megoldották. Izolált pancreasductus-sejteket szövetkultúrában tartottak. A tenyésztés utolsó fázisában hormonok és növekedési faktorok megfelelő kombinációjának hatására a sejtek szigetszerű képződményekké differenciálódtak, s inzulint kezdtek termelni. Az így kezelt sejteket mindezek után diabetikus egerek veséjébe implantálták. Kísérletük teljes sikerrel járt: az implantáción átesett diabeteszes állatoknak nem volt szükségük a továbbiakban inzulinkezelésre, a vércukorszint szabályozását átvették a beültetett sejtek.6
Emberi transzdifferenciált szigetsejtekkel még nem sikerült a fentiekkel azonos sikert elérni, azaz még nem történt meg ilyen sejtek emberbe ültetése, és a vércukorszint kontrolljának ilyen módon történő megoldása. Azonban minden bizonnyal ez is hamarosan bekövetkezik, mivel a kulcslépés, a transzdifferenciáció megtörténtéről a harvardi Bonner-Weir és munkatársai már beszámoltak.7 Ők ugyancsak donorból szigetizoláció során visszamaradó acinussejtek tenyésztésével indultak. Az így tenyésztett sejtek a megelőző beszámolókhoz hasonlóan ductalis morfológiát vettek fel. Bonner-Weir ekkor a monolayerben, azaz egy rétegben növő sejteket felülről is beborította egy kémiailag csak részben definiált alapréteggel, az úgynevezett Matrigellel. Ennek hatására a sejtek háromdimenziós struktúrákat, ductuskezdeményeket, egy részük pedig szigetszerű csoportosulásokat alkotott. A szigetszerű sejtekben elektronmikroszkópiával a különböző szigetsejttípusok morfológiai jeleit mutató sejteket sikerült kimutatni. Emellett immuncitokémiai, illetve radioimmunoassay módszerrel ténylegesen is mérhető volt az inzulin, a glukagon, a szomatosztatin, illetve a pancreas-polipeptid termelése ezekben a sejtekben.7
Összefoglalásként azt mondhatjuk, hogy a diabetes mellitus gyógyításának megoldásában számos más manipulációs megoldás is kínálkozik, így a transzdifferenciáció mellett a klónozás, illetve pluripotens őssejtek megfelelő kezelésével inzulintermelő sejtek létrehozása. Ugyanakkor mind etikai, mind szakmai szempontból e technikák közül a ductussejtek transzdifferenciációjával létrehozott inzulintermelő sejtek alkalmazása tűnik a legígéretesebbnek.
Irodalom
1. Bockman, DE: Development of the pancreas and related structures. (In: Beger, H [ed.]: The pancreas. Blackwell Science Ltd, Edinborough, 1998.) pp. 3-10.
2. Edlund, H: Factors controlling pancreatic cell differentiation and function. Diabetologia 44: 1071-1079, 2001.
3. Gradwohl, G, Dierich, A, LeMeur, M, Guillemot, F: Neurogenin3 is required for the development of the four endocrine cell lineages of the pancreas. Proc Natl Acad Sci USA 97:1607-1611, 2000.
4. Heller, RS, Stoffers, DA, Bock, T, Svenstrup, K, Jensen, J, Horn, T, Miller, CP, Habener, JF, Madsen, OD, Serup, P: Improved glucose tolerance and acinar dysmorphogenesis by targeted expression of transcription factor PDX-1 to the exocrine pancreas. Diabetes 50: 1553-1561, 2001.
5. Gmyr, V, Kerr-Conte, J, Belaich, S, Vandewalle, B, Leteurtre, E, Vantyghem, MC, Lecomte-Houcke, M, Proye, C, Lefebvre, J, Pattou, F: Adult human cytokeratin 19-positive cells reexpress insulin promoter factor 1 in vitro: further evidence for pluripotent pancreatic stem cells in humans Diabetes 49:1671-1680, 2000.
6. Ramiya, VK, Maraist, M, Arfors, KE, Schatz, DA, Peck, AB, Cornelius, JG: Reversal of insulin-dependent diabetes using islets generated in vitro from pancreatic stem cells. Nature Med 6: 278-282, 2000.
7. Bonner-Weir, S, Taneja, M, Weir, GC, Tatarkiewicz, K, Song, KH, Sharma, A, O'Neil, JJ: In vitro cultivation of human islets from expanded ductal tissue. Proc Natl Acad Sci USA 97: 7999-8004, 2000.
- A szerző levelezési címe: Dr. Varga Gábor
- MTA Kísérleti Orvostudományi Kutatóintézet
- 1083 Budapest, Szigony u. 43