Debreceni Orvostudományi Egyetem, II. sz. Belklinika
DIABETES MELLITUS ÉS HAEMOSTASIS
Udvardy Miklós dr.
Összefoglalás
A szerző röviden áttekinti a diabeteses angiopathiához és a
cukorbetegséghez társuló haemostasis zavarok kapcsolatának irodalmát. Ezen belül
ismerteti saját munkacsoportjának diabetes mellitusban kapott néhány, a fokozott
thrombocytaműködésre és a fibrinolysis zavarára utaló eredményét is. Foglalkozik a
thrombocytak inzulinreceptorainak funkciójával. Röviden értékeli a perioperativ
vénás thromboembolia profilaxis fontosabb kérdéseit diabetesben. Cukorbetegségben, s
különösen az inzulindependens formában a thrombocyta túlműködés már az
érszövődmények megjelenése előtt kimutatható. E jelenség fontos szerepet játszhat
a microangiopathia és általában a diabetes érszövődmények kialakulásának
patomechanizmusában. Az alvadásfehérjék és a fibrinolytikus rendszer eltérései
állnak előtérben a nem-inzulin-dependens diabeteses esetekben.
Diabetes mellitus and haemostasis
Summary
After a brief review of diabetes
and haemostasis the author describes some results of their own previous haemostatic
investigations in diabetes mellitus. Special attention was given to platelet insulin
receptors and perioperative thromboembolic prophylaxis in diabetes mellitus. Platelet
hyperfunction, which certainly accelerates the development of microangiopathy seems to be
present sooner in IDDM than the documented angiopathy. In NIDDM coagulation-factor and
fibrinolysis abnormalities are the predominant, most characteristic haemostatic
alterations.
A diabetes mellitus és a haemostasis rendszerének kapcsolata az érszövődmények patogenezise szempontjából rendkívül jelentős. A WHO korábbi felmérése25 szerint a cukorbetegekben a cerebrovascularis betegségek és a szívinfarctusok száma a nem cukorbetegekének kétszerese, a szerzett microangiopathiás vakság a tízszerese, az alsó végtagi gangraena (macroangiopathia vagy diabeteses láb) pedig hússzoros gyakoriságot ér el. A vese diabeteses angiopathiája a renális eredetű halálozás gyakoriság szerinti második elöidéző tényezője.
A diabeteses verőeres szövődmények alapvetően macro- és microangiopathiára oszthatók. A macroangiopathia lényege a szokottnál gyorsabb, durvább érfal calcificatióval járó nagyér arteriosclerosis. A microangiopathia főleg IDDM-re, de korántsem csak erre a típusra jellemző súlyos szövődmény, mely ma a betegek élettartamát és életminőségét döntően meghatározza.
A microangiopathia eredményezi a retinopathia, a kapilláris glomerulosclerosis és más tényezőkkel együtt a diabeteses cardiomyopathia képét.6 Lényege a kapilláris membrán megvastagodásával, permeabilitás zavarával járó lokális anyagcserezavar és szövetkárosodás. A microangiopathiát a valószínűleg fontos genetikus tényezők mellett közvetlenül a hyperglykaemia káros hatása idézi elő: az érfal fehérjék és a haemoglobin nem-enzymatikus glikozilációja, rosszabb oxigéntranszport, a hyperglykaemia miatti fokozott polyol anyagcsereút inert és erősen ozmotikus metabolitjai stb. Fontosak azok az úgynevezett lokális, szöveti haemodynamikai és endothelium anyagcserehatások, amelyek eredményeképp bizonyos szervek (szem, vese stb.) microangiopathiája határozza meg döntően a szövődmény kialakulásának helyét. A hyperglykaemia következtében fokozott a lipidperoxidáció, mely maga is képes vérlemezke-aktiváció kiváltására, illetve befolyásolhatja az alvadási faktorok anyagcseréjét.3 A glikolizált vagy oxidált LDL önmagában is káros hatású, mivel az acetilált LDL-receptorhoz is kötődik, így kórossá válik a sejt koleszterin anyagcseréje, nő a macrophagok koleszterintartalma.2 Romlik az LDL/HDL arány, s ez csökkenti az endothel prosztaciklin szintézisét.2,3,4,13,26
Diabetes és primer haemostasis
A sérült endothelium és az így szabaddá váló subendothelialis felszín adhezív tényezői (kollagén, von Willebrand-faktor) a thrombocyták kitapadásához, aggregációjához és pár másodpercen belül az elsődleges thrombocyta thrombus megjelenéséhez vezet. Ezt a döntően az érfal és a vérlemezkék kölcsönhatásán alapuló rendszert primer haemostasisnak nevezzük.16
A primer haemostasis zavara diabetes mellitusban jól dokumentálható. Fokozott az in vivo thrombocyta aktiváció: megnő a thrombocyta volumen, ami lényegében a megszokottnál fiatalabb thrombocyta populációt jelez. Nagyobb a keringő aggregátumok száma, magasabb a thrombocyta specifikus, s így az in vivo vérlemezke-aktiváció mértékét jelző béta-thromboglobulin plazmatikus szintje, erőteljesebb az adhézió, fokozott ütemű a thrombocyták arachidonsav-anyagcseréje, thromboxan produkciója és érzékenysége.2,3,4,7,12,15,19 Az eltérések kifejezettebbek az érszövődményes esetekben. IDDM-ben a fokozott thrombocyta aktivációt a kezdeti időszakban valószínűleg maguk az alapbetegséggel kapcsolatos immunkomplexek is előidézhetik.6 A thrombocyta strukturfehérjék glikozilációja feltételezhetően önmagában nem okoz változást a vérlemezke müködésében.27
Kérdéses, hogy a sokféleképp dokumentált thrombocyta-hiperfunkció a microangiopathia okának vagy inkább következményének tekinthető-e? E kérdésre a válasz pontosan és egyértelműen máig sem adható meg. Valószínűleg igaz az, hogy a microangiopathia előidézésében a glukometabolikus okok játszanak vezető szerepet. A thrombocytaműködés zavara teszi a képet teljesebbé, s mértéke minden bizonnyal jelentősen befolyásolja a szövődmény súlyosságát, a kórlefolyást.
Kétségtelen, hogy a mérsékelt thrombocyta-hiperfunkció korán, már a manifeszt angiopathia előtt is megjelenik. Erre magunk is felhívhattuk a figyelmet 1983-ban, friss diabeteses gyermekekben, kimutatható érszövődmény nélkül is magasabb volt az in vivo thrombocyta aktivációt jelző plazma béta-thromboglobulin szint. Az endothel károsodását jelző von Willebrand-faktor koncentráció ugyanekkor még normális volt.15 A plazma prosztanoidok szintje is a fokozott aggregációnak kedvező módon változik diabetesben, azaz a thromboxan-metabolit-szint magasabb.19 Az ugyancsak gyermekkori cukorbetegségben végzett vizsgálataink arra utalnak, hogy nem a betegség tartama, nem is a fluoroeszcens szemfenék-angiográfia, hanem a haemoglobin-A1c a prosztanoid anyagcserezavar szempontjából a döntő eltérés.14
A thrombocytamembrán funkcionálisan defektív inzulin kötőhelyeinek a száma NIDDM-ben ugyanúgy csökken, mint más célsejteken.18 Nem ismert, illetve vitatott, hogy e receptorok rendelkeznek-e valamiféle funkcióval. Magunk a közelmúltban in vitro adatok alapján (thrombocyta malondialdehid képzés különféle stimulusok után inzulin jelenlétében és anélkül) arra mutathattunk rá, hogy az e receptorokhoz történő inzulinkötődés a vérlemezke működést gátolhatja. Ez az egyébként viszonylag szerény gátlás IDDM-ben és NIDDM-ben egyaránt elvész, sőt az arachidonsav okozta thrombocyta-aktiváció magas in vitro inzulinkoncentráció mellett jelentősen fokozott.21 Elképzelhető, hogy az inzulin okozta enyhe thrombocyta inhibíció elvesztése is hozzájárul a cukorbetegségben észlelhető vérlemezke-működészavar kialakulásához.
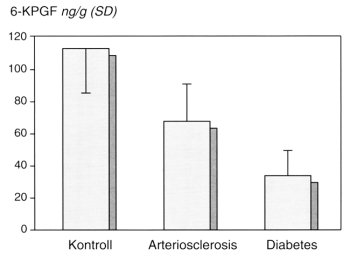
Az endothel prosztaciklin produkciója, a savónak az endotheliumra gyakorolt prosztaciklin szintézist serkentő biológiai aktivitása, különösen az NIDDM-esetekben korán csökkenhet.10 A szérumban lévő, az endothel prosztaciklin produkcióját stimuláló komplex biológiai hatásának elvesztéséért, csökkentéséért valószínűleg az LDL-struktúra glikációja is felelős. A cukorbetegségben észlelhető szérum prosztaciklin szintézist stimuláló aktivitás csökkenését, patkányaorta-gyűrűket használva saját adataink alapján demonstráljuk (1. ábra). A PSA-mérés technikáját korábbi közleményünkben ismertettük.20 E jelenség pontos kórélettani hatását nehéz meghatározni, s ez még inkább igaz a keringő prosztaciklin metabolitszint-változásokra.

1. ábra: A szérum prosztaciklinstimuláló aktivitásának vizsgálata. 6-KPGF: ketoprostaglandin-F1-alfa
Fontosak azok a megfigyelések, melyek diabetesben, különösen pedig a retinopathiás esetekben magasabb plazmatikus von Willebrand-faktor szintet találtak.4,12,15 A von Willebrand-faktor plazmaszintjének emelkedése az endothelium károsodásának jelzője, bár az eredmények értékelésénél figyelembe kell venni, hogy a faktor szintje szeszélyesen változhat, hiszen ezen molekula végső soron úgynevezett akut-fázis fehérje.
A thrombocyta-hiperfunkció és a microangiopathia kapcsolata egyértelmű, bár a részletek nem tekinthetők tisztázottnak. A kérdés összetettségét jelzi, hogy a jól értékelhető vérlemezke-túlműködés ellenére thrombocyta-működést gátlókkal végzett tanulmányok eredménye inkább csalódást kelthet. Az aszpirin biztosan nem alkalmas a manifeszt diabeteses retinopathia kezelésére, de talán a profilaxisára sem. Valamivel jobb a helyzet a ticlopidine (Ticlid) esetében.13 Mindazonáltal egyik "antiplatelet" szer hatékonysága sem közelíti meg a normoglykaemiára törekvő kezelés terápiás értékét inzulin-dependens cukorbetegségben.
A koagulációs rendszer változásai diabetes mellitusban
A fibrinogén szintézise már a csökkent glukóztolerancia idején is fokozódik, s ehhez manifeszt diabetesben a fibrinogén élettartam csökkenése is társul. A szintézis növekedése az erőteljesebb, ez azt eredményezi, hogy diabetesesekben a plazma fibrinogénszintje 60-80 mg/dl-rel magasabb, mint egészségesekben.13 A fibrinogén glikációja általában csekély mértékű. A fibrinogént kódoló gén a cukorbetegség egyes típusaiban megváltozhat, s leírták azt is, hogy diabetesben a fibrin szerkezete az egészségesekétöl eltérő lehet.17
Az érsérülést követően, a sérült felszínen a XII. alvadási faktor aktiválódik, s ez az úgynevezett kontakt aktiváció több lépésen keresztül az aktív X. alvadásfaktor képződése ütemének növekedéséhez vezet. Ez a kontakt fázis aktívabb, a VII. és VIII. faktor szintje pedig magasabb diabetesben.4 Az emelkedés mértéke és a hyperglykaemia, valamint az obesitas között ismerhető fel összefüggés.4,13,26 Kétségtelen azonban, hogy a véralvadás kontakt fázisának élettani jelentősége egyre inkább kérdésesnek látszik. Nagyobb fiziológiás szerepe a szöveti alvadási faktornak és az így bekövetkező gyors thrombinképződésnek lehet, de ezen aktivációs út változásai diabetesben még kevéssé ismertek. Kétségtelen azonban, hogy diabetesben a thrombingeneráció gyakran fokozódott. Ezt jelzi, hogy például a fibrinopeptid-A szintje diabetesben gyakorta 2-4-szer magasabb, mint a hasonló korú, nemü egészségesekben.3,13
Az antithrombin III szintje diabetesben magasabb, a molekula biológiai aktivitása pedig kisebb, mint egészségesekben. Utóbbit a fehérje glikációjával magyarázzák.3,13 A molekula defektív funkciója, a heparin kofaktor II rosszabb kötődése és a vaszkuláris lipoprotein lipáz-heparin kapcsolódás eltérő viszonyai magyarázzák, hogy a nem frakcionált heparin hatása, hatékonysága diabetesben elmarad a nem-diabetesesekben tapasztalhatóhoz képest.
Beszámoltak diabetes mellitusban a protein C és S szintjének csökkenéséről is.24 Vélhetően tovább mélyíti a haemostasis zavarát diabetesben az endothel-protektív endogén heparinszulfátok képzésének csökkenése.3 Ezen anyagok csökkent ütemű képzésének különösen a diabeteses nephropathia patogenezisében tulajdonítanak nagy jelentőséget.
A fibrinolyticus rendszer tökéletlenül működik diabetesben, s e kérdésnek ma egyre nagyobb figyelmet szentelnek. Az endothelium szöveti plazminogén aktivátor képzése jelentősen csökken diabetes mellitusban.3,4,13,26 Maga az obesitas is csökkenti a fibrinolysist, ugyanis elhízásban nagyobb mennyiségű fibrinolysis inhibitor keletkezik. Az inzulin, söt a proinzulin hatására is az egyik fontos plazminogén-aktivátor inhibitor (PAI-1) endothelialis és májbeli képződése egyaránt jelentősen fokozódik.13 Ez az eltérés gátolhatja a fibrinolysist akár a manifeszt diabetest évekkel megelőző csökkent glukóztolerancia időszaka során is. A plazminogén-aktivátorok és inhibitorok arányának ezen kedvezőtlen változásai így minden bizonnyal komoly szerepet játszanak az "X"-, vagy "multimetabolikus szindrómában" kialakuló vaszkuláris események, szövődmények patomechanizmusában.3,4
Ugyanakkor sok ellentmondó adat is napvilágot látott a fibrinolysissel kapcsolatosan manifeszt cukorbetegségben. Ezt nem kis részben az magyarázza, hogy nincs igazán jó, a globális fibrinolysisröl tájékoztató, viszonylag egyszerű laboratóriumi alapmódszer. Inzulin-dependens cukorbetegségben a fibrinolysis sebessége gyakran normális, vagy gyorsult. Jóllehet, az érszövődményes betegek fibrinolytikus paraméterei rosszabbak, mint a szövődménymenteseké, de egyik csoport eredményei sem döntően rosszabbak a kontrollcsoporténál. Nemritkán fokozott ütemű fibrinolysisre utaló leleteket is kaphatunk IDDM-ben. Az NIDDM-ben pedig inkább lassult a fibrinolysis üteme.4 A fentieket jól példázza saját eredménysorozatunk, amelyet diabetesben végzett in vitro alvadék oldási próbával nyertünk.23 Az általunk alkalmazott teszt elsősorban a fibrinolysis inhibitoraira érzékeny. IDDM-ben gyors, normális és lassú lysist egyaránt találtunk, míg NIDDM-ben gyakoribb volt a csökkent ütemű alvadék oldás. A fibrinolysis próba eredménye és a fibrinogén szintje között csak NIDDM-ben kaptunk értékelhető negatív korrelációt. Az eredményeket a 2. ábra szemlélteti.
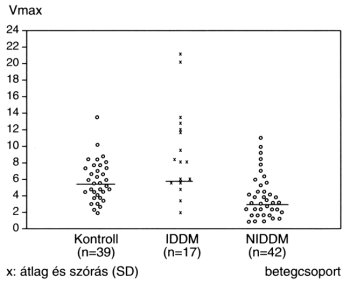
2. ábra: Az in vitro fibrinolysis sebességének vizsgálata diabetesben
Az orális antidiabetikumok némelyike (a legtöbb adat a gliclazidról ismert) mérsékelheti a fibrinolysis zavarát cukorbajban.3
Diabeteses mellitusban a primér haemostasis, a koagulációs rendszer és a fibrinolysis egyensúlya thrombotikus irányba tolódik el. Biokémiai alapon tehát a cukorbetegség prothrombotikus állapotként definiálható. A vénás thromboembolia gyakorisága - a várakozással talán ellentétben - azonban nem lényegesen nagyobb jól beállított cukorbetegeken, mint a hasonló korú, nemű, testsúlyú és társuló rizikótényezőkkel rendelkező nem-cukorbetegekben.3,4,13,20,25
Egyértelműen fokozott a thromboembolia hajlam az időskori, hyperosmolaris típusú diabeteses anyagcsere krízisben, kómában. Ez esetekben a haemostasis vizsgálata, és kis adagú (de érthető módon nem subcutan alkalmazott!) heparinadás a kómaterápia fontos része lehet.20
A diabetesben fellépő általános oxidatív anyagcserehatások jelentős szerepet játszanak a primer haemostasis és a koagulációs rendszer eltéréseinek kialakulásában. Ellensúlyozásukra antioxidánsok lehetnének alkalmasak, de átütő sikert diabetesben ez a kezelési mód eddig nem hozott.3
Diabetes mellitus és perioperatív thrombosis-kockázat
A műtéti vénás thromboemboliás szövődményre hajlamosító, szélesebb körben elfogadott kockázati tényezők között a cukorbetegség főbb formáit önálló faktorként általában nem szerepeltetik.1,8,11 Nyilvánvaló, hogy az obesitas a cukorbetegek jelentős részénél a fokozott kockázatba történő besorolást eredményezi, de a teendők valószínűleg nem különböznek az adiposus cukorbeteg és az egyszerű elhízott esetében.
Bár a haemostasis zavara diabetesben jól ismert és kifejezett, s ezért a műtéti thrombosis profilaxis szisztematikusabb alkalmazása logikusnak látszik, az eddigi gyakorlatban ez mégsem nyert teret. Kevés olyan központ van, mely a diabetest - akár kisebb rizikótényezőként - a preoperatív rizikóértékelő protokollba beveszi.1,9 A diabetes és a haemostasis zavarok közti kapcsolat jobb megismerése e téren elindítja azokat a prospektív, kettős-vak, multicentrikus tanulmányokat, melyek alapján a perioperatív vénás thrombosis profilaxis értékét a diabetes mellitus különböző típusaiban reálisan meghatározhatjuk.
Diabetes mellitusban, a thromboembolia kezelésekor, vagy megelőzésekor több elméleti megfontolás szólhat a kis molekulasúlyú heparin választása mellett. Diabetes mellitusban az antithrombin III glikált volta miatt a konvencionális heparin (mely hatását jelentős részben az antithrombin III-on keresztül fejti ki) a megszokottól eltérő, gyengébb effektusú lehet. A kis molekulasúlyú heparin döntően az aktív X. faktor gátlásán keresztül fejti ki alvadásgátló hatását, s ez diabetesben is változatlanul érvényesül. Mivel a kis molekulasúlyú heparinkészítmény lipolytikus hatása is kisebb, adása anyagcsereszempontból is előnyösebbnek gondolható.5 A kis molekulasúlyú heparin a vaszkuláris endotheliumból kisebb mennyiségű lipoprotein lipázt mobilizál.5,6,8
A kis molekulasúlyú heparin adását a műtét előtt 4-12 órával kezdve ajánlják (napi 1´ 2500 E), s folytatva az adagolás ezen módját hatékony, egyszerű, laboratóriumi kontrollt (X. faktor-aktivitás mérése) kevéssé igénylő perioperatív profilaxis biztosítható. Ha adását csak a posztoperatív időszakban tudjuk elkezdeni, úgy talán a napi kétszeri kis molekulasúlyú heparinalkalmazás is kívánatos lehet.8
A haemostasis zavara diabetes mellitusban a belgyógyászaton belüli interdiszciplináris klinikai kutatás jó példája, annak szakmailag fontos és releváns területe. Számos adattal szolgált az angiopathia patogeneziséről, az érszövődmények és a haemostasis-zavar együttes befolyásolása, korrekciója azonban eleddig be nem teljesült igény és remény maradt cukorbetegségben.
IRODALOM
1. Arcelus, JI, Candocia, S, Traverso, CI, Fabrega, F, Caprini, JA, Hasty, JH: Venous thromboemolism prohylaxis and risk assessment in medical patients. Semin Thromb Hemostas 18:313-318, 1991.
2. Aviram, M: Modified forms of LDL and atherosclerosis. Ahterosclerosis 98:1-12, 1993.
3. Ceriello, A: Coagulation activation in diabetes mellitus. The role of hyperglycaemia and therapeutic prospects. Diabetologia 36: 1119-1125, 1993.
4. Colwell, JA: Vascular thrombosis in type II diabetes mellitus. Diabetes 42:8-19, 1993.
5. Engelberg, H: Heparin and the prevention of atherosclerosis. Wiley Liss, New York p. 105, 1990.
6. Fein, FS: Heart disease in diabetes. Cardiovasc Rev Rep 3:877-882, 1982.
7. Halushka, PV: Increased platelet arachidonic acid metabolism in diabetes mellitus. Diabetes 30:44-48, 1981.
8. Hirsh, J, Levine, MN: Low molecular weight heparin. Blood 89:1-9, 1992.
9. Husted, SE: Principles of thromboprophylaxis in Surgical Patients. Semin Thromb Haemostas 18:254-261, 1991.
10. Inoguchi, T, Umeda, F, Ono, H, Kunisaki, M, Watanabe, J, Nawata, H: Abnormality in prostacycline stimulatory activity in sera from diabetics. Metabolism 38:837-842, 1989.
11. Lowe, GDO: Epidemiology of postoperative deep vein thrombosis and pulmonary embolism. Seminbol Thromb Haemostas 18: 248-251, 1991.
12. Mayne, EE, Bridges, JM, Weaver, J: Platelet adhesiveness, fibrinogen and factor VIII levels in diabetes mellitus. Diabetologia 6:436-444, 1980.
13. McMillan, DE: Clotting disorders in diabetes. In: International textbook of diabetes mellitus (Eds: Alberti KGMM, DeFronzo RA, Keen H, Zimmet P) John Wiley & Sons, Chichester p. 1448, 1992.
14. Orosz L., Udvardy M, Fehér A, Vincze P, Madácsy L.: Blood glucose concentration and diabetic retinopathy. Br Med J 304: 1244-1245.
15. Rák K, Beck P, Udvardy M, Pfliegler Gy, Misz M, Boda Z: A béta-thromboglobulin és a VIII faktor antigén plazmaszintjének vizsgálata diabeteszes gyermekekben és felnőttekben. Magy Belorv Arch 35:281-287, 1982.
16. Rosenberg, RD: Physiology of coagulation: The fluid phase. In: Haematology of Infancy and childhood (Eds: Nathan DG, Oski FA) Saunders, Philadelphia p. 34, 1988.
17. Tsianos, EB, Stathakis, NE: Soluble fibrin complexes and fibrinogen heterogenity in diabetes mellitus. Thromb Haemostas 44: 130-136, 1980.
18. Udvardy M, Pfliegler Gy, Rák K: Pletelet insulin receptor determination in non-insulin dependent diabetes mellitus. Experientia 41: 422-423, 1985.
19. Udvardy M, Török I, Rák K: Plasma thromboxane and prostacycline metabolite ratio in atherosclerosis and diabetes mellitus. Thromb Res 48: 479-484, 1988.
20. Udvardy M: Thrombotikus eltérések diabetes mellitusban, májbetegségekben, immunológiai kórképekben és más belgyógyászati betegségekben. Laboratóriumi Diagnosztika 19:86-91, 1992.
21. Udvardy M, Hársfalvi J, Pósán E, Rák K: Possible role for platelet insulin receptors to modulate platelet function in health and diabetes mellitus. Platelets 4:287-288, 1993.
22. Udvardy M, Pósán E, Rák K: Interference of platelets with fibrinolysis. Rev Yberoam Thromb Hemostas 7:7-10, 1994.
23. Udvardy M, Pósán E: A fibrinolysis vizsgálata diabetes mellitusban. Orv Hetil 135:2025-2028.
24. Vukovich, TC, Schernthaner, G: Decreased protein C levels in patients with IDDM. Diabetes 35: 618-622, 1986.
25. WHO Expert committee on Diabetes Mellitus: Technical report series 646, WHO, Geneva 2nd report, p. 85, 1980.
26. Winegard, AL: Does a common mechanism induce the diverse complications of diabetes mellitus? Diabetes 38: 311-323, 1985.
27. Yatscoff, RW, Mehta, A, Gerrard, JM, Thlivers, J: Glycation of platelet protein in diabetes mellitus, lack of correlation with platelet function. Clin Biochem 20: 359-363, 1988.