Országos Kardiológiai Intézet, Budapest
VÉRCUKORCSÖKKENTŐ SULPHONYLUREA KÉSZÍTMÉNYEK HATÁSA A SZÍV MEMBRÁN-CSATORNÁIRA
Pogátsa Gábor dr.
Összefoglalás
Az ATP-érzékeny kálium csatornát nyitó vegyületek védik a szívizomzatot és ritmuszavart okoznak. Az ATP-érzékeny kálium csatornát bénító vegyületek viszont ritmuszavart csökkentő hatásúak és fokozhatják a szívizom károsodását. A vércukorcsökkentő, ATP-érzékeny kálium csatornát bénító sulphonylurea vegyületek - a napi adagtól függően - eltérő hatást gyakorolnak a szívműködésre. A napi 20 mg alatti mennyiségben is vércukorcsökkentő hatású glibenclamid mérsékli, a napi 50 mg mennyiségnél nagyobb adagban vércukorcsökkentő hatású sulphonylurea vegyületek pedig fokozzák a ritmuszavarok okozta károsodásokat szívizom ischaemiában. A reperfusio okozta ritmuszavarokat a várakozással ellentétben sem a glibenclamid, sem a többi vizsgált sulphonylurea vegyület nem befolyásolja. Ezért az ATP-érzékeny kálium csatornát bénító vegyületek egyelőre még ellentmondásos hatása nem kényszeríti az orvosokat arra, hogy az antidiabetikus kezelést tablettáról inzulinra változtassák minden koszorúér-betegségben szenvedő cukorbetegnél. A bemutatott adatok alapján azonban csak glibenclamidot ajánlott adnunk digitalizált vagy koszorúér-betegségben szenvedő, II. típusú cukorbetegnek, ha az anyagcsere-állapot rendezése étrenddel és az életmód változtatásával önmagában nem lehetséges, és sulphonylurea kezelés válik szükségessé. Más a helyzet ellenben akkor, ha a kórházba heveny szívizom infarctusban szenvedő, II. típusú cukorbeteg érkezik. Ekkor az az ésszerű megoldás, hogy az antidiabetikus kezelést átmenetileg inzulinra állítsuk át, mivel ebben az időpontban a heveny szívizom ischaemia okozta kamrafibrillatio veszélye már jelentősen csökken, az ischaemiás szívizomterület perfusiójának helyreállítása pedig időszerű.
Effect of hypoglycaemic sulphonylurea compounds on the membrane channels of the heart
Summary
ATP-sensitive potassium channel activators are cardioprotective and proarrhytmic. Conversely, ATP-sensitive potassium channel blockers enhance mechanical myocardial recovery following ischaemia and are antiarrhythmic. The investigated ATP-sensitive potassium channel blocker sulphonylurea compounds exert different effects on cardiac functions. Glibenclamide, which is hypoglycaemic in a daily dose lower than 20 mg, decreases, while other investigated sulphonylurea compounds, which are hypoglycaemic only in higher than 50 mg daily doses, enhance arrhythmias induced by myocardial ischaemia. However, neither glibenclamide nor tolbutamide exert any antiarrhythmic effect on the munber of reperfusion-induced venticular ectopic beats or on the duration of reperfusion-induced transition venticular fibrillation. Therefore, the confounding influence of ATP-sensitive potassium channel blockers during myocardial infarction does not press the physicians to shift the antidiabetic treatment from oral agents to insulin in diabetics suffering from coronary heart disease. Nevertheless, in the light of the presented data, only glibenclamide is proposed to be preferred it satisfactory metabolic control cannot be achieved with diet alone and sulphyonylurea treatment becomes necessary in digitalized non-insulin-dependent diabetic patients or in non-insulin-dependent diabetic patient suffering from coronary heart disease. Nevertheless, when a non-insulin-dependent diabetic patient suffering from acute myocardial infarction has reached the hospital, the logical conclusion might be to shift the antidiabetic treatment temporarily fromoral agents to insulin, since an effort for reperfusion is usually stressed at this time, and the risk of venticular fibrillation or tachycardia due to the acute onset of ischaemia is largely over.
A különböző típusú membráncsatornák közül az adenozintrifoszfátra (ATP) érzékeny kálium csatornák játsszák az egyik legfontosabb szerepet a szívben az akciós potenciál kialakításában és a koszorúerek vezetőképességének szabályozásában. Akciós potenciál csak a haránt- és simaizomsejtek, az idegsejtek, valamint a hasnyálmirigy b -sejtjeinek membránjain keletkezik. Ebből adódik, hogy az ATP-érzékeny kálium csatornát bénító sulphonylurea vegyületek hatásukat csak ezeken a sejteken fejtik ki, továbbá, hogy a kálium csatornák és a sulphonylureák hatása csak ezeken a sejteken tanulmányozható.
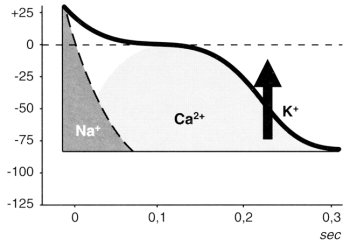
A sejtmembránban elhelyezkedő, energiaigényes nátrium-kálium pumpa folyamatos működése biztosítja, hogy a nátrium és a kalcium ionok koncentrációja az extracellularis, a kálium ionoké pedig az intracellularis térben nagyobb. Ez mintegy 50-95 mV negatív feszültséget idéz elő a sejten belül. Továbbá, ez az ionkülönbség vezet a nátrium ionok "spontán" sejtbe, és a kálium ionok sejtből történő áramlásához, amit a sejtmembránban elhelyezkedő energiaigényes nátrium-kálium pumpa állandóan korrigál. Amikor a sejtmembránban elhelyezkedő különböző ionokra fajlagos csatornák, egymástól eltérő időben kinyílnak, a nátrium, kálium vagy kalcium ionok áramlása nagymértékben fokozódik és ezt a fokozott ki-, illetve beáramlást a nátrium-kálium pumpa már nem képes korrigálni. Így alakul ki a nátrium, majd a kalcium ionok sejtbe áramlása révén a depolarizáció, amely elindítja az akciós potenciál kialakulását, illetve a kálium ionok extracellularis irányú kiáramlása révén a repolarizáció, amely véget vet az akciós potenciál fennállásának. Egészséges körülmények között, a szívizomsejtek elektromos depolarizációjának kezdetén, amint a nyugalmi transzmembrán potenciál csökkenni kezd, a feszültség iránti különböző érzékenységük következtében előbb a nátrium, majd kalcium csatornák nyílnak ki. Így először nátrium, majd kalcium ionok áramlanak a szívizomsejtbe, amelyek elindítják a sejtek belsejének pozitívvá válását, vagyis az akciós potenciál kialakulását. A depolarizáció folyamán azután, a feszültségváltozások hatására előbb a nátrium, majd a kalcium ionok számára záródnak be a membráncsatornák, és így kialakul az akciós potenciál gyors, majd elhúzódó szakasza. Ezt követően a sejten belüli ATP-töménység számottevően csökken, kinyílnak az ATP-érzékeny kálium csatornák. A kálium ionok kiáramlanak a szívizomsejtekből. Így ismét negatívvá válik a sejtek belseje, és befejeződik az akciós potenciál (1. ábra).1

1. ábra: Ionmozgások szerepe az akciós potenciál kialakulásában a szívizomsejtekben
A hypoxia vagy az ischaemia lecsökkenti a szívizomsejtekben az ATP-szintet. Következésképper hypoxia vagy ischaemia esetén a normális állapotnál korábban nyílnak ki az ATP-érzékeny kálium csatornák az elektromos depolarizáció folyamán. Ezeknek a csatornáknak a működésbe lépése pedig lerövidíti a szívben az akciós potenciál időtartamát,1 továbbá koszorúér-tágulatot idéz elő.2 Az akciós potenciál időtartamának ez a lerövidülése úgynevezett "reentry" típusú ritmuszavarok kialakulására hajlamosítja a szívet, különösen akkor, ha társul hozzá az elektromos szétkapcsolódás ("electric uncoupling") megkésése3 és a refractaer időszakoknak az ép és az ischaemiás szívizomsejtek között kialakuló egyre kifejezettebb eltérése.4
Ez a jelenség pedig kamrafibrillatiót idézhet elő. Más a helyzet az ischaemiát követő reperfusio során. Ekkor az akciós potenciál idötartamának rövidülése kivédheti a repolarizáció-zavar okozta ritmuszavarokat.5,6 Így az ATP-érzékeny kálium csatornák befolyásolása kétélű kardhoz hasonlítható.
Az akciós potenciál időtartamának rövidülése a kalcium ionok áramlását is csökkenti elektromos systoléban. Így az ATP-érzékeny kálium csatornák kinyílása gyorsítja az ischaemiás területeken a szívizom-összehúzódások megszűnését, és az ezáltal előidézett nyugalmi állapot mérsékli a magas energiatartalmú foszfátkötések csökkenését az ischaemiás szívizomsejtekben.7
A vércukorcsökkentő hatású sulphonylurea vegyület, a glibenclamid bénítja az ATP-érzékeny kálium csatornák működését anélkül, hogy befolyásolná az ATP iránti érzékenységüket.8 Ezért glibenclamid jelenlétében kevésbé csökken a szívizomsejtek akciós potenciáljának időtartama hypoxiában vagy ischaemiában. Tehát a glibenclamid mérsékelni képes a refractaer időszakok egyenlőtlensége miatt kialakuló ritmuszavarokat szívizom ischaemiában.9-11 Reperfusióban ellenben a glibenclamid akciós potenciál időtartamát növelő hatása fokozhatja a repolarizációzavar okozta ritmuszavarokat.9-11
Az ATP-érzékeny kálium csatornákat bénító sulphonylurea vegyületek azonban eltérő módon befolyásolják a membráncsatornákat. Fosset és munkatársai12 például nagyobb kötődést észleltek a szívizomsejtekben az ATP-érzékeny kálium csatornáktól függő receptorokhoz a napi 20 mg alatti, mint a napi 50 mg feletti mennyiségben vércukorcsökkentő hatású sulphonylurea vegyületek esetében. Továbbá a glibenclamid nem befolyásolja, a tolbutamid pedig mérsékli az anoxia okozta, kifelé irányuló áramot a hippocampus idegsejtjeiben.13 Warnick és munkatársai14 kimutatták, hogy a glibenclamid nem befolyásolja, a tolazamid és a tolbutamid pedig jelentősen mérsékli a kalcium-ATP-ase enzim aktivitását a szívizomsejtek membránjaiban. Munkacsoportunk vizsgálata szerint a glibenclamid lényegesen gyengébb hatást fejt ki az izolált békaszív membráncsatornáira, mint a tolbutamid.15 Az is ismert, hogy a glibenclamid rendkívül magas zsíroldékonysága miatt sokkal nagyobb mennyiségben halmozódik fel a hasnyálmirigy b -sejtjeiben, mint a tolbutamid vagy a glipizid.16
A sulphonylureák ezen eltérö hatásai, valamint a koszorúér-átáramlásra gyakorolt esetleges kedvezőtlen, később tárgyalt befolyásai magyarázhatják, hogy a glibenclamid nem befolyásolja, a tolbutamid és más vizsgált sulphonylurea készítmény pedig növeli a halálos kimenetelű szívizom infarctusok előfordulását II. típusú cukorbetegségben.15 Továbbá, a glibenclamid mérsékli, a többi vizsgált sulphonylurea készítmény pedig nem befolyásolja a kamrafibrillatio kialakulását heveny szíviram infarctusban.17 A glibenclamid kivédi, a többi vizsgált sulphonylurea készítmény ellenben fokozza a digitalis által kiváltott multifocalis kamrai extrasystolék fellépését.15,18-20 Glibenclamid, a gliclaziddal összevetve csökkenti a kamrai extrasystolék számát digitalisszal kezelt cukorbetegekben a 24 órás ambuláns EKG-vizsgálatok adatai szerint is21 A glibenclamiddal, inzulinnal vagy pusztán étrenddel kezelt cukorbetegek túlélési ideje pedig jelentősen hosszabb, mind az angina pectoris első rohamát, mind az első szívizom infarctust követően azokhoz a betegekhez viszonyítva, akiket egyéb sulphonylurea készítménnyel kezeltek.22
A glibenclamid és a glipizid csökkenti, a többi vizsgált sulphonylurea vegyület ellenben fokozza a heveny szívizom infarctus okozta ritmuszavarokat patkányban23 és a strophantin okozta szívizom-toxicitást nyúlban.19,20,24
A fenti eltérések létrejöttét magyarázhatja még a sulphonylurea vegyületeknek a membráncsatornákra gyakorolt eltérő hatása mellett az a tény is, hogy a glibenclamiddal kezelt, digitalizált cukorbetegek vérében a sulphonylurea- és a digoxinszint jelentősen alacsonyabb, mint gliclazidkezelés során.21 Ez a jelenség a gliclazidnál tizenötször kisebb napi glibenclamid-adagnak tulajdonítható, és felveti a vegyületek albuminkötődésének szerepét. Lehetséges ugyanis, hogy a magasabb sulphonylurea vérszint kiszorítja a digoxint az albuminkötődésböl. Ezáltal emelkedik a digoxin vérszintje és szívizom-toxicitása. További magyarázatul szolgál, hogy kutyákban15,25-27 és nyulakban26 a glibenclamid és a glipizid nem befolyásolja, a többi vizsgált sulphonylurea vegyület ellenben kifejezetten emeli mind az artériás középnyomást, mind a szívizom-összehúzódási erőt. Tehát a glibenclamid és a glipizid nem befolyásolja, a többi vizsgált sulphonylurea vegyület ellenben fokozza a szívizom által végzett munkát és ezáltal a szívizom oxigénfelhasználását, illetve igényét.
Fontos megemlítenünk, hogy várakozásunkkal ellentétben sem a glibenclamid, sem a tolbutamid nem fokozza a reperfusio okozta ritmuszavarokat patkányban. Így sem a glibenclamid, sem a tolbutamid nem hat a koszorúér-lekötés utáni reperfusio okozta kamrai extrasystolék számára vagy az átmeneti kamrafibrillatiók idejére ezekben az állatokban.28
Az ATP-érzékeny kálium csatornáknak szerepet tulajdonítanak az úgynevezett "preconditionálás" folyamatában is.29-31 A "preconditionálás" jelenségét Murry és munkatársai32 ismerték fel. Megfigyelésük szerint a koszorúér-elzáródás káros következményei sokkal kisebbek, ha azt egy órán belül megelőzi egy vagy rövid több ideig tartó szívizom ischaemia. Észlelésük szerint a jelenség nem a kollaterális ér kinyílásának vagy kialakulásának, hanem az átmeneti ischaemiára a szívizomban bekövetkező anyagcsere-változásoknak a következménye. A "preconditionálás"jelenségével kapcsolatban néhány kutató arról számolt be, hogy az ATP-érzékeny kálium csatornát bénító sulphonylurea vegyületek eltörlik a preconditionálás hatását a szívizomban.30,33 Más szerzők azonban ezt a megfigyelést nem tudták megerősíteni.34
Amint már szóba került, az ATP-érzékeny kálium csatornáknak fontos szerepe van a koszorúerek vezetőképességének szabályozásában is.35-36 A hypoxia vagy ischaemia kinyitja ugyanis az erek simaizomsejtjeiben az ATP-érzékeny kálium csatornákat az ATP-tartalom csökkentése révén. Ez pedig a simaizomsejtek repolarisatiós zavarához vezet. A repolarisatio-zavar hatására bezárulnak a feszültség-érzékeny kalcium csatornák és ezáltal csökken a kalcium ionok beáramlása az erek simaizomsejtjeibe. Ez értágulatban és a hypoxia, illetve ischaemia mérséklésében nyilvánul meg.2 Az ATP-érzékeny kálium csatornák bénítása, pl. glibenclamiddal, kifejezetten csökkenti ezért a koszorúér vérátáramlását. Ez a csökkentés nyugalomban sokkal kifejezettebb, mint fizikai terhelés során (2. ábra).37
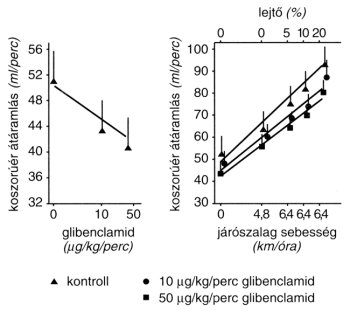
2. ábra: Glibenclamid hatása a koszorúér vérátáramlásának alakulására (átlag +/- SEM) kutyában, nyugalomban (ábra bal oldala) és fizikai terhelés alatt (ábra jobb oldala)
Az anyagcsere folyamatainak megváltozása nemcsak fizikai terhelés során, hanem egyéb vonatkozásban is befolyásolja az ATP-érzékeny kálium csatornák bénításának következményeit. Cukorbetegségben pl. romlanak az ATP-érzékeny kálium csatornák működése által kiváltott hatások.38,39 Az újonnan kifejlesztett sulphonylurea vegyület - a glimepirid 40- pedig egészséges állapotban fokozza, cukorbetegségben ellenben mérsékli egyrészt a strophantin okozta szívizomtoxicitást, másrészt a vérnyomás és a perctérfogat nagyságát.41
Megállapíthatjuk tehát, hogy az ATP-érzékeny kálium csatornát nyitó, illetve bénító vegyületeknek a szívizom ischaemiában egyelőre még távolról sem egyértelmű hatása további tanulmányozást igényel. Az azonban már bizonyos, hogy koszorúér-betegségben az ATP-érzékeny kálium csatorna bénításának három egymástól eltérő hatása van.1 Egyrészt, az ATP-érzékeny kálium csatorna bénítás koszorúér-összehúzódást idéz elő és ezáltal növeli az infarctus nagyságát. Másrészt, az ATP-érzékeny kálium csatorna bénítás csökkenti az enzimfelszabadulást az ischaemiás szívizomsejtekböl és fokozza az inzulin-elválasztást. Az inzulinnak pedig közvetlen értágító és vérellátást javító hatása van. Harmadrészt, ATP-érzékeny kálium csatorna bénítással megelőzhető azoknak a korai, súlyos, esetleg halálos kamrai ischaemiás arrhythmiáknak a kialakulása, amelyeket az extracellularis térben a káliumszint hirtelen kialakuló emelkedése okoz heveny szívizom infarctusban, az elhalt szívizomsejtekből kiáramló korai káliumvesztés következtében.
Az ATP-érzékeny kálium csatornát bénító vegyületeknek ez a korántsem egyértelmű hatása az, amely nem teszi kötelezővé, hogy koszorúér-betegség esetén minden cukorbetegnél tablettáról inzulinra változtassuk az antidiabetikus kezelést. A bemutatott adatok alapján azonban ajánlatos csak glibenclamidot adnunk a digitalizált vagy koszorúér-betegségben szenvedő, II. típusú cukorbetegnek, ha az anyagcsere-állapot rendezése étrenddel és életmód-változtatással önmagában nem lehetséges, és sulphonylurea kezelés válik szükségessé. Más a helyzet ellenben akkor, ha a kórházba heveny szívizom infarctusban szenvedő, II. típusú cukorbeteg érkezik. Ekkor az ésszerű megoldás, a sulphonylurea készítményeknek a reperfusiós arrhythmiákra esetlegesen kifejtetten provokatív hatása, valamint a koszorúér-átáramlásra gyakorolt esetleges kedvezőtlen befolyása miatt, hogy az antidiabetikus kezelést átmenetileg inzulinra állítsuk át, mivel ebben az időpontban a heveny szívizom ischaemia okozta kamrafibrillatio veszélye már jelentősen csökken, az ischaemiás szívizomterület pertusiójának helyreállítása pedig időszerű.
IRODALOM
1. Opie, LH: Channels, pumps, and exchtmgers. In: Opie, LH (Ed.): The Heart. Physiology and metabolism. Raven Press, New York, NY, pp. 67-101, 1991.
2. Gasser, R, Brusse, H, Wallner, M: Current views on mechanisms of vasodilation in response to ischaemia and hypoxia. Intern J Angiology 2: 22-32, 1993.
3. Tan, HL, Mazón, P, Verberne, H.J, Sleeswijk, ME, Coronel, R, Opthof T, Janse, MJ: Ischaemic preconditioning delays ischaemia induced cellular electrical uncoupling in rabbit myocardium by activation of ATP-sensitive potassium channels. Circ Res 7l: 664-651, 1993.
4. Siegl, P: Cardiovascular controversies: Blockers of ATP-sensitive potassium channels. Circ Res 28: 31-33, 1994.
5. Fish, FA, Prakash, C, Ronden, DM: Suppression of repolarization-related arrhythmias in vitro and in vivo by low-dose potassium channel activators. Circulation 82: 1362-1369, 1990.
6. Gross, GJ, Auchampach, JA: Role of ATP-dependent potassium channels in myocardial ischatemia. Cardiovasc Res 26: 1011-1016, 1992.
7. Cole, WC, McPherson, CD, Sontag, D: ATP-regulated K+-channels protect the myocardium against ishcaemia reperfusion damage. Circ Res 69: 571-.581, 1991 .
8. Sturgess, NC, Ashford, MLJ, Cook, DL, Hales, CN: The sulphonylurea receptor may be an ATP-sensitive potassium channel. The Lancet II: 474-475, 1985.
9. Billman, C.F, Avendano, CE, Halliwilt, JR. Burroughs, JM: The effect of the ATP-dependent potassium channel antagonist, glyburide, on coronary blood flow and suscept.ibility to ventricular fibrillation in unanesthetized dogs. J Carcliovasc Pharmacol 21 : 197-204, 1993.
10. Smallwood, JK, Ertel, PJ, Steinberg, MI: Modification by glibenclamide of the electrophysiological consequences of myocardial ischaemia in dogs and rabbits. Naunyn Schmiedebergs Arch Pharmacology 342: 214-220, 1990.
11. Tosaki, A, Hellegouarch, A: Adenosine triphosphate-sensitive potassium channel blocking agent ameliorates, but the opening agent aggravates, ischaemia/reperfusion-induced injury. J Am Coll Cardiol 23: 487-496, 1994.
12. Fosset, M, de Weille, JR, Green, RD, Schmid-Antomarchi, H, Lazdunski, M: Antidiabetic sulphonylureas control action potential properties in heart cells via high affinity receptors that are linked to ATP-dependent K+-channels. J Biological Chemistry 263: 7933-7936, 1988.
13. Godfraind, JM, Krnjevic, K:Tolbutamidesuppressesanoxic outward current of hippocampal neurons. Neuroscience Letters 162: 101-104, 1993.
14. Warnick, PR, Davis, FB, Davis, PJ. Mylotte, KM, Blas, SD: Differential activities of tolbutamide, tolazamide and glyburide in vitro on rabbit myocardial membrane Ca++-transporting ATPase activity. Diabetes 35: 1044-1048, 1986.
15. Pogátsa G: Possible cardiac benefits of hypoglycaemic sulphonylureas. In: Papp JG (Ed.): Cardiovascular Pharmacology, Akadémiai Kiadó, Budapest, pp. 151-162, 1987.
16. Panten, U, Zünkler, BJ, Scheit, S, Kirchhoff, K, Lenzen, S: Regulation of energy metabolism in pancreatic islets by glucose and tolbutamide. Diabetologia 29: 648-654, 1986.
17. Lomuscio, A, Marano, L, Vergani, D: Azione antifibrillatoria delta glibenclamide nell'infarto miocardico acuto. (Meeting abstract) Cardiologia 38 (Suppl.2.): 6, 1993.
18. Pogátsa G: Is glibenclamide the only hypoglycaemic sulphonylurea which is not arrhythmogenic in digitalized patients? Diabetes News 7: 7-8, 1986.
19. Pogátsa G, Koltai MZ, Balkányi I, Dévai J, Kiss V.: Effects of various hypoglycaemic sulphonylureas on the cardiotoxicity of glycosides. Eur J Clin Pharmacol 28: 367-370, 1985.
20. Pogátsa G, Koltai MZ, Balkányi I, Dévai J, Kiss V, Köszeghy A: The effect of various hypoglycaemis sulphonylureas on the cardiotoxicity of glycosides and arrhthmogenic activity due to myocardial ischaemia. Acta Physiol Hung 71: 243-250, 1988.
21. Pogátsa G, Koltai MZ, Ballagi-Pordány G: Influence of hypoglycaemic sulphonylurea compounds on the incidence of ventricular ectopic beats in non-insulin-dependent diabetic patients treated with digitalis. Current Ther Res Clin Exp 53: 329-339, 1993.
22. Pogátsa G, Koltai MZ, Jermendy Gy, Simon J, Aranyi Z, Ballagi-Pordány G: The effect of sulphonylurea therapy on the outcome of coronary heart dieases in diabetic patients. Acta Med Hung 49: 39-51, 1993.
23. Ballagi-Pordány G, Köszeghy A, Koltai MZ, Pogátsa G: Divergent cardiac effects of the first and second generation hypoglycaemic sulfonylurea compounds. Diabetes Res Clin Pract 8: 109-114, 1990.
24. Ballagi-Pordány G, Köszeghy A, Koltai MZ, Aranyi Z, Pogátsa G: Effects of first and second generation sulphonylureas on cardiotoxicity of strophanthin in rabbits. Diabetes Res 12: 193-197, 1989.
25. Ballagi-Pordány G, Koltai MZ, Aranyi Z, Pogátsa G: Direct effect of hypoglycaemic sulphonylureas on the cardiovascular system of dogs. Diab Clin Pract 11: 47-52, 1991.
26. Ballagi-Pordány G, Németh M, Aranyi Z, Kékesi E, Koltai MZ, Papp G, Pogátsa G: Effect of glimepiride on the electrical activity of isolated rabbit heart muscle. Arzneimittel-Forschung 42, 111-113, 1992.
27. Pogátsa G, Dubecz E: The direct effect of hypoglyaemic sulphonylureas on myocardial contractile forte and arterial blood pressure. Diabetologia 13: 515-519, 1977.
28. Pogátsa G, Koltai MZ, Pósa I, Kocsis E: Effect of hypoglycaemic sulphonylurea compounds on reperfusion-induced arrhythmias in rats. (in prepatation)
29. Tajima, M, Katayose, D, Bessho, M, Isoyama, S: Acute ischaemic precondtioning and chronic hypoxia independently increase myocardial tolerance to ischaemia. Cardiovasc Res 28: 312-319, 1994.
30. Grover, GJ, Sleph, PG, Dzwonczyk, S: Role of myocardial ATP-sensitive potassium channels in mediating preconditioning in the dog heart and their possible interaction with adenosine A1-receptors. Circulation 86: 1310-1316, 1992.
31. Yao, Z, Gross, GJ: A comparison of adenosine-induced cardioprotection and ischaemic preconditioning in dogs. Circulation 89: 1229-1236, 1994.
32. Murry, CE, Jennings, RB, Reimer, KA: Preconditioning with ischaemia: a delay of lethal cell injury in ischaemic myocardium. Circulation 74: 1124-1136, 1986.
33. Gross, GJ, Auchampach, JA: Blockade of ATP-sensitive potassium channels prevents myocardial preconditioning in dogs. Circ Res 70: 223-233, 1992.
34. Fralix, TA, Steenbergen, Ch: Glibenclamide does not abolish the protective effect of preconditioning on stunning in the isolated perfused rat heart. Cardiovasc Res 27: 630-637, 1993.
35. Komaru T, Kanatsuka H, Dellsperger, K, Takishima, T.: The role of ATP-sensitive potassium channels in regulafing coronary microcirculation. Biorheology 30: 371-380, 1993.
36. Nakae, I, Quan, L, Sugimoto, Y, Tsutamoto, T, Kinoshita, M: Glibenclamide-induced oscillation of canine coronary artery is independent of myocardial ischaemia. J Cardiovasc Pharmacol 23: 473-479, 1994.
37. Duncker, DJ, VanZon, NS, Altman, JD, Pavek, TJ, Bache, RJ.: Role of ATP-sensitive potassium channels in coronary vasodilation during exercise. Circulation 88: 1245-1253, 1993.
38. Sexton, WL, Waack, BJ: Diabetes impairs relaxation to ATP-sensitive K+ channel activation in rat aortic rings. (Meeting abstract) F.A.S.E.B.J. 8: A1058, 1994.
39. Mayhan, WG, Faraci, FM: Responses of cerebral arterioles in diabetic rats to activation of ATP-sensitive potassium channels. Am J Physiol 265: H152-H157, 1994.
40. Donaubauer, HH, Mayer, D: Acute, subchronic and chronic toxicity of the new sulfphonylurea glimepiride in rats. Arzneimittel-Forschung 43: 547-549, 1993.
41. Kottai MZ, Pósa I, Tóth K, Pogátsa G: Is the atrhythmogenesis influencing effect of sulphonylureas depending on metabolic state? (Meeting abstract) J Mol Cell Cardiol 26: 122,1994.