Semmelweis Orvostudományi Egyetem, I. Belgyógyászati Klinika, Budapest
INZULIN-ANALÓGOK KIFEJLESZTÉSÉNEK ÉS ALKALMAZÁSÁNAK ELMÉLETI HÁTTERE*
Gerő László dr.
Összefoglalás
A szerző az ún. inzulin-analógok kifejlesztésének indokait foglalja össze. Gyors hatású inzulin subcutan injekciója után a maximális serum inzulinszint az endogén inzulincsúcshoz képest csak nagy késéssel alakul ki. Ennek oka az, hogy az inzulinmolekula dimer, majd hexamer formát vesz fel, és emiatt felszívódása a subcutan szövetekböl lassított. A B-lánc megfelelő módosításával ez az ön-asszociáció kivédhető és így a felszívódás gyorsítható. A fenti módszerrel számos gyors hatású inzulin-analógot állítottak elő experimentális és klinikai használatra, közülük a fontosabbakat ismerteti a szerző. Az intermedier inzulinok nem biztosítanak elég egyenletes és tartós vérszintet. A B-lánc carboxy-terminalis végének módosítása olyan elhúzódó hatású analógok előállításához vezetett, amelyek stabil és egyenletes inzulinszintet tartanak fenn akár 24 órán át is. Mindezen analógok klinikai kipróbálása folyamatban van.
Kulcsszavak: inzulin-analógok, inzulin dimer, inzulin hexamer, IGF-1
Theoretical background of the development and application of insulin analogues
Summary
The author summarizes the data necessitating the development of so-called insulin analogues. Following subcutaneous insulin injection, peak concentration of insulin in the serum will be attained with great delay in comparison with that produced by endogenous insulin secretion. The slow absorption of insulin from subcutaneous tissues is caused by the formation of insulin dimer and hexamer structures. The self – association of insulin molecules can be prevented and the absorption rate increased by appropriate modification of the B-chain. Using this method, various insulin analogues have been produced recently and examined under experimental and clinical conditions. The characteristics of the most important analogues are described by the author. Therapeutical intermedier insulins do not maintain long-lasting and smooth serum insulin concentrations. Modification of the carboxy-terminal end of the B-chain resulted in insulin analogues with stable and prolonged action lasting even for approximately 24 hours. The clinical use of these analogues is in investigational phase.
Key words: insulin analogues, insulin dimer, insulin hexamer, IGF-1
* Az 1996 októberében, Kremsben tartott Lilly Konferencia előadása alapján. Az inzulin-analógok klinikai alkalmazásaival kapcsolatos tapasztalatokat egy másik közlemény foglalja össze, melyet következő számunkban jelentetünk majd meg.
1980-ban a Stanfordi Egyetem kutatói kidolgozták a humán inzulin rekombináns géntechnológiával történő előállítására szolgáló módszert. E technológia sikeres ipari méretű adaptációja gyakorlatilag korlátlan méretű inzulintermelést biztosított, azaz a gyártó cégeket nem korlátozta többé a rendelkezésre álló pancreas limitált mennyisége. A bioszintetikus humán inzulin széleskörű klinikai alkalmazása pedig minimálisra csökkentette az inzulinkezelés ún. immunológiai szövődményeinek (allergia, lipodystrophia, antitestes rezisztencia) gyakoriságát.
E terápiás siker ellenére az utóbbi években egyre több, kémiai szerkezetében módosított, azaz a humán inzulinétól eltérő aminosavszekvenciájú inzulin-analóg került előállításra és kipróbálásra kísérleti, majd klinikai körülmények között. A leírtak alapján joggal merül fel a kérdés, hogy mi indokolta a humán inzulin kémiai szerkezetének módosítását, mi tette szükségessé ún. analógok előállítását?
A kérdés megválaszolásához vizsgáljuk meg a subcutan inzulin beadása után kialakuló serum inzulin koncentrációkat és hasonlítsuk azokat össze a fiziológiás inzulinszintekkel.
Az inzulinsecretio egészséges egyéneken
A fiziológiás inzulinelválasztás nagyjából két összetevöre bontható:
(a) basalis secretióra, amely alacsony rátájú, egyenletes és folyamatos hormonelválasztást jelent, valamint
(b) bolusokban történő gyors, bifázisos inzulin-kiáramlásra az étkezések idején.
(a) A basalis inzulinsecretio a serumban 5–15 mU/l inzulinkoncentrációt biztosít. Feladata elsősorban a hepatikus glukóztermelés gátlása, s ezzel az étkezések közötti, ill. a hajnali vércukoremelkedés kivédése. Hatására a máj éppen csak annyi glukózt bocsát a keringésbe, amennyi az életfontos szervek, elsősorban az agy sejtjeinek alapműködéséhez szükséges.
(b) Az étkezések során, a vércukorszint emelkedésének kezdetén (de kellö kondicionálás esetén reflexesen már az étel megpillantásakor is) prompt inzulinkiáramlás következik be. Ez az inzulinelválasztás bifázisos, korai csúcsa 2–5 percen belül, ehhez csatlakozó elhúzódó fázisa pedig 15–45 perc múlva éri el a maximális serumkoncentrációt. Mintegy két óra elteltével az inzulin-secretio visszatér az alapszintre, és a következő étkezésig ismét basalis rátával folyik tovább.
Egészséges egyénekben napi háromszori föétkezés mellett tehát három bifázisos inzulincsúcsot regisztrálhatunk, amelyeket a közti étkezések még tovább módosíthatnak. Az étkezésmentes időszakokban, ill. az éjszaka során viszont alaprátájú, egyenletes inzulinkiáramlás folyik.1 (A fenti, kissé leegyszerűsített leírásban a pulzációs inzulin secretio ismertetésétöl eltekintettem).
Terápiás inzulinszintek
Az inzulinkezelést úgy célszerű irányítanunk, hogy az exogén inzulin bevitele után kialakuló serum inzulin koncentrációk a fiziológiás inzulin-elválasztást utánozzák. Ezt leginkább úgy érhetjük el, hogy a három föétkezés előtt gyors hatású inzulint, éjszakára pedig intermedier (basis) készítményt alkalmazunk. Az így kialakuló serum inzulin szintek azonban még mindig jelentősen eltérnek a fiziológiástól, mivel:
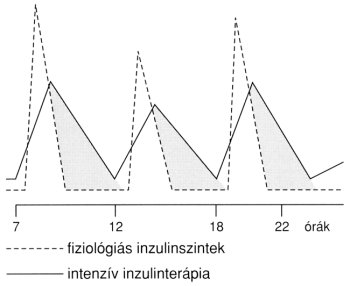
(a) a subcutan adott gyors hatású inzulin csúcskoncentrációja az injekció után csak 1,5–2 órával alakul ki, és a hatás 4–6 óra alatt zajlik le (szemben a 15–45 perc alatt maximális koncentrációt elérő és 2 óra elteltével az alapszintre visszatérő prandialis endogén inzulinsecretióval). Emiatt közvetlenül az étkezést követően a serum inzulin-szintjének emelkedése elmarad a kívánatostól, és így a vércukorszint az optimálisnál magasabbra emelkedik, 2 óra múlva viszont „inzulinfelesleg" található a vérben, így a hypoglykaemia kivédése céljából közti étkezések beiktatása szükséges (1. ábra).2

1. ábra: Plazma inzulinszintek étkezést követő endogén inzulinelválasztás és étkezés előtt adott subcutan inzulininjekció hatására. Jól megfigyelhető, hogy az exogén inzulin csúcskoncentrációja jelentősen késik, hatása pedig elhúzódik az endogén inzulinéhoz képest (a satírozott területek az "inzulinfelesleget" jelölik).
(b) a subcutan adott intermedier inzulin nem biztosít egyenletes vérszintet. A beadást követően a serum inzulinkoncentrációja fokozatosan emelkedik, és maximumát kb. 6 óra múlva éri el. Ezt követően az inzulinszint csökkenő. Így az éjfél utáni órákban hypoglykaemia, kora reggelre viszont hyperglykaemia alakulhat ki.
Miért késleltetett a terápiás inzulin absorptiója a subcutan szövetekböl?
Az inzulinmolekula igen erős ön-asszociációs hajlammal rendelkezik. Két molekula összetapadva először dimert képez, majd – neutrális közegben, Zn-ionok jelenlétében – három dimerböl egy hexamer keletkezik. Ez a folyamat az inzulin bioszintézise során már a béta-sejtekben végbemegy: a proinzulin a béta-sejteken belül a Golgi-apparátusban hasad ketté inzulinra és C-peptidre. Ezután az inzulin hexamer kristályok formájában tárolódik a secretiós granulumokban, megakadályozván így a további enzimatikus bontást. Stimulus hatására a kiáramló inzulin a keringésben erősen felhígulva monomer molekulákra esik szét és a receptorokhoz is monomer formában kötödik.3
A terápiás inzulin is jelentős részben hexamer formában található a különböző ampullás kiszerelésekben. Mivel ezt a struktúrát az inzulin a subcutan szöveti depókban is megtartja, érthető, hogy a 6000 dalton molekulasúlyú monomer inzulinnal szemben a mintegy 36000 dalton molekulasúlyú hexamer absorptiója erősen lelassult.4,5,6,7 Ha tehát a subcutan adott inzulin absorptióját gyorsítani akarjuk, akkor meg kell akadályoznunk a dimer- és hexamer-képződést.
Régóta ismert, hogy az inzulinmolekula egyes láncrészei más-más biológiai hatásért felelősek. Az antigénhatást az A-lánc megfelelő aminosavai, a receptorhoz való kötödést viszont elsősorban a B-lánc bizonyos aminosavai határozzák meg. Ugyancsak a B-lánc középső részén lévő B8–13, B16, és a lánc vége felé esö B23–28-as pozíciójú aminosavak felelősek a molekula ön-asszociációs hajlamáért. Utóbbiak közül kiemelten fontos a B28-as pozíciójú prolin.8 A receptor-kötésért és a dimerizációért felelős molekularészek részben azonosak (2. ábra).
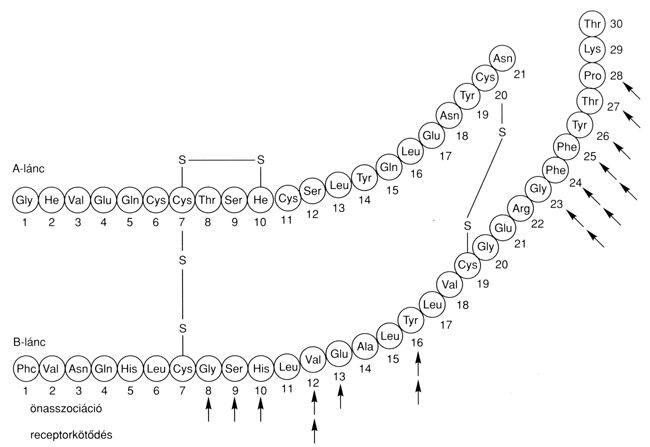
2. ábra: Humán inzulin aminosav szerkezete. A nyilak az ön-asszociációban, ill. a receptorkötödésben szerepet játszó aminosavakat jelölik.
Ha a dimerizációt meg akarjuk akadályozni, akkor az inzulin B-láncát a felsorolt pozíciók valamelyikén kell módosítanunk. A kémiai módosítás történhet valamelyik aminosav (egy vagy több) elhagyásával, cseréjével, vagy esetleg a molekula egy szakaszán az aminosav sorrend módosításával. Az elmúlt években szinte mindegyik variációval próbálkoztak, az alábbiakban röviden a különböző eljárásokkal kialakított analógok tulajdonságait ismertetem.
különböző inzulin-analógok biológiai tulajdonságai.
1. Aminosav(ak) elhagyásával nyert analógok
A B25-, 26-, ill. 27-es pozíciójú aminosavak elhagyásával nyert analógokra (des-B25-Phe, des-B26-Tyr és des-B27-Tyr) egyaránt az jellemző, hogy nemcsak absorptiójuk gyorsult meg a subcutan szövetböl, hanem biológiai potenciáljuk is nött. In vitro vizsgálatok szerint hatáserősségük mintegy másfélszerese a natív humán inzulinénak.9
2. Aminosav(ak) cseréjével nyert analógok
Egy ilyen módon nyert inzulin-analóg a B9Asp+B27-Glu variáns, ahol tehát a B-láncon két helyen is cserét hajtottak végre: a 9-es pozíciójú serint asparaginsavra, a 27-es pozíciójú threonint pedig glutaminsavra cserélték. Ez az analóg mind egészséges, mind diabeteses egyéneknek adva szignifikánsan gyorsabban szívodott fel a subcutan depókból, mint a natív humán inzulin, és ennek megfelelően a serum inzulinkoncentráció emelkedése, ill. a vércukor csökkenése is szignifikánsan hamarabb következett be az analóg alkalmazásakor (3. ábra).10,11,12
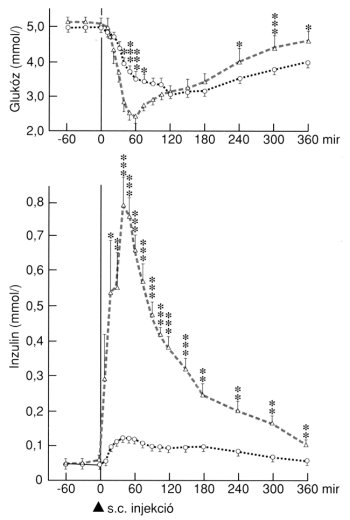
3. ábra: Lent: serum inzulin koncentrációk, Fent: vércukorszintek változása egészséges kontroll egyéneken inzulin-analóg és natív humán inzulin (o-o) subcutan adása után. *:p<0.05, **:p<0.01, ***:p<0.001
Egy további analógot nyertek úgy, hogy a B-lánc 10-es pozíciójú aminosavát, egy histidil molekulát asparaginsavra cseréltek. Az így nyert variáns subcutan absorptiója a kétszerese, az inzulinreceptorhoz való affinitása pedig háromszorosa volt a humán inzulinénak. Ugyanakkor a B10-Asp analóg jól kötödött a humán IGF-1 (insulin-like growth factor-1) receptorhoz is. In vitro vizsgálatokban mitogén aktivitása 20-szorosa volt a natív humán inzulinénak. In vivo vizsgálatokban nöstény patkányokban 1 éves kezelés során szignifikánsan növelte a mamma tumor incidenciáját.13
A leírt mellékhatás kialakulásában fontos szerepe lehet annak a ténynek, hogy a B10-Asp analóg térbeli konfigurációja az IGF-1-hez közelített. Ez magyarázhatja az IGF-1 receptorhoz való fokozott affinitást is. Ezzel viszont a molekula biológiai hatása is az IGF-1 hatása felé tolódott: növekedett ezen analóg mitogén, sejtproliferatív aktivitása.
Az IGF-1 aminosav szekvenciája számos hasonlóságot mutat a proinzulin primer szerkezetével. Ezen belül az inzulin B-láncának 20–30. aminosava részben azonos az IGF-1 megfelelő láncrészletének aminosavaival (1. táblázat). Minden olyan további módosítás, amely az inzulin szerkezetét e növekedési faktor szerkezete felé közelíti, potenciálisan a mitogén és sejtproliferációs aktivitás növelésének veszélyét rejti magában.14
| Inzulin B-lánc, 20-30 aminosavak | ||||||||||
| 20 | 21 | 22 | 23 | 24 | 25 | 26 | 27 | 28 | 29 | 30 |
| Gly | Glu | Arg | Gly | Phe | Phe | Tyr | Thr | Pro | Lys | Thr |
| IGF-1 láncrészlet | ||||||||||
| Gly | Asp | Arg | Gly | Phe | Tyr | Phe | Asp | Lys | Pro | Thr |
1. táblázat: Szerkezeti hasonlóság a humán inzulin és az IGF-1 között
Mint említettem, a dimer képződésben fontos szerepe van a B28-as prolinnak. Ezen aminosav asparaginra történő cseréje (B28-Asp) egy előnyös tulajdonságú analógot eredményezett, amelylyel mind az experimentális, mind a klinikai vizsgálatok kedvezönek mutatkoztak.15
3. Aminosavak sorrendjének módosítása
Az előbbiekhez képest kisebb mértékű módosítást jelent két szomszédos aminosav sorrendjének felcserélése. Ismerve a B28-prolin jelentőségét a dimer-képződésben, ezen aminosav elmozdítása a
28-as pozícióból, felcserélése a B29-es lysinnel a molekula ön-asszociációs hajlamának jelentős csökkenéséhez vezetett. Az így keletkezett inzulin-molekulában tehát a B-lánc két utolsó előtti aminosavának sorrendje nem Prolin-Lysin, hanem Lysin-Prolin, s a rövidítés alapján ez az analóg Lispro inzulin néven vált ismertté.16
A Lispro inzulin biológiai tulajdonságai
1. In vitro vizsgálatok
A Lispro inzulin a natív humán inzulinnal azonos erősséggel kötödött placentáris inzulinreceptorokhoz és IG-M lymphocyták inzulinreceptoraihoz. Ugyanakkor izom és placenta IGF-1 receptorokhoz másfélszer nagyobb affinitást mutatott, mint a humán inzulin (de ez még mindig csak 0,1%-a volt az IGF-1 hasonló affinitásának).
Zsírsejteken a Lispro inzulin a humán inzulinnal azonos módon növelte a glukózfelvételt és a glukóz transzporter rendszer szintézisét.6,7
Izolált sejtrendszerekben (Escheria coli, patkánymájsejt-tenyészet, egércsontvelö) a Lispro nem bizonyult toxikusnak, több osztódáson át követve nem okozott kromoszóma aberrációt.
Humán mamma epithelsejtek növekedését a Lispro inzulin gyakorlatilag nem befolyásolta (ugyanezen vizsgálatban a B10-Asp közel húszszoros növekedésfokozódást okozott).
2. In vivo vizsgálatok
Patkányokon az ún. 50%-os hypoglykaemia eléréséhez 7,2±0,3 µg/kg Lispro, ill. 7,8±0,1 µg/kg humán inzulinra volt szükség. Ezek alapján, ha a natív humán inzulin hatáserősségét 100%-nak vették, akkor a Lispro inzuliné 108%-nak adódott.
Patkányokon – több generáción át vizsgálva – nem bizonyult toxikusnak, nem befolyásolta a fertilitást, nem volt teratogen hatása.17 Rhesus majmokban, Freund-adjuvánssal együtt adva, a natív humán inzulinnal egyenlő – nem szignifikáns mértékű – antitestképződést okozott.
Mindezen kedvező eredmények után került a Lispro inzulin az utóbbi években klinikai kipróbálásra.
Egyéb analógok
Csupán a teljesség kedvéért említem meg, hogy előállítottak olyan inzulinvariánsokat is, amelyek különböző erősséggel hatnak az egyes célszervekre. Így pl. az N-B1-thyroxyl-(T4)-inzulin-analóg részlegesen „máj-szelektív", azaz hatása elsősorban a hepatikus glukózleadás gátlására irányul.18 Kérdés, hogy ilyen analógoknak az inzulinrezisztencia kezelésében a jövöben szerep jut-e.
Ha az inzulinmolekulát meghosszabbítjuk úgy, hogy a B-lánc utolsó aminosavát elhagyva a 29-es lysinhez egy tetradecanoyl-gyököt kötünk, olyan analógot nyerhetünk amely lassan felszívódva igen egyenletes vérszintet biztosít akár 24 órán át is.19
Egy másik, hasonlóan elnyújtott és egyenletes hatású inzulinvariáns a B21-AspB31-32-diarginin inzulin, (amelyben tehát a proinzulin-inzulin átalakuláskor kihasadó két arginin molekulát „visszacsatolták" a B-lánc végéhez). Ez az analóg (HOE 901) szintén elhúzódó, stabil serum koncentrációt biztosít.20,21 Mindkét fent leírt elhúzódó hatású analóg klinikai alkalmazása a kipróbálás fázisában van.
IRODALOM
1. Hansen, A, Johansen, K: Diurnal patterns of blood glucose, serum fatty acids, insulin, glucagon, and growth hormone in normal and juvenile diabetes. Diabetologia 6: 27-33, 1970.
2. Trautmann, ME: Effect of the insulin-analogue Lys(B28), Pro(B29) on blood glucose control. Horm Metabol Res 26: 588-90, 1994.
3. Howell, SI: Insulin biosynthesis and secretion. (In: Pickup, J, Williams, G. eds.: Textbook of Diabetes. Blackwell Sci Publ, Oxford, 1991,) pp. 72-83.
4. Hildebrandt, P, Sejrsen, P, Neilsen, SL, Birch, K, Sestoft, L: Diffusion and polymerisation determine the insulin absorption from subcutaneous tissue in diabetic patients. Scand J Clin Lab Invest 45: 685-90, 1985.
5. Brange, J, Owens, DR, Kang, S, Volund, A: Monomeric insulins and their experimental and clinical implications. Diab Care 13: 923-954, 1990.
6. Radziuk, J, Candas, B, Davies, J, Yang, M, DiMarchi, R, Chance, R: The absorption kinetics of subcutaneously injected insulin and two monomeric analogs. Diabetes 40: (Suppl.l): 456A, 1991.
7. Radziuk, J, Davies, J, Pye, S, DiMarchi, R, Shields, J, Chance, R: Subcutaneous absorption of fast-acting insulin-analogs: kinetics and bioeffectiveness. Diabetologia 35: (Suppl.l): A3, 1992.
8. Ciszak, E, Beals, JM, Frank, BH, Baker, JC, Carter, ND, Smith, GD: Role of C-terminal B-chain residues in insulin assembly: the structure of hexameric Lys(B28)Pro(B29)-human insulin. Structure, 3: 615-622, 1995.
9. Balschmidt, P, Brange, J: Fast acting human insulin-analogues with a single amino acid deletion in the B-chain. Diabetologia 35(Suppl. 1); A4, 1992.
10. Vora, JP, Owen, DR: Future trends in insulin therapy: clinical implications of novel insulin-analogues and nasal administration of insulin. (In: Mogensen, CE, Standl, E. eds.: Pharmacology of diabetes. Walter de Gruyter, Berlin-New York, 1991), pp. 39-56.
11. Vora, JP, Owens, DR, Dolben, J, Atiea, JA, Dean, JD, Kang, S, Burch, A, Brange, J: Recombinant DNA derived monomeric insulin-analogue: comparison with soluble human insulin in normal subjects. Brit Med J 297: 1236-9, 1988.
12. Kang, S, Owens, D, Vora, JP, Brange, J: Comparison of insulin-analogue B9AspB27Glu and soluble human insulin in insulin-treated diabetes. Lancet 335: 303-6, 1990.
13. Jorgensen, LN, Dideriksen, LH, Drejer, K: Carcinogenic effect of the human insulin-analogue B10-Asp in female rats. Diabetologia 35 (Suppl.l): A3, 1992.
14. Wood, SP, McLored, A: The structure and phylogeny of insulin. (In: Pickup, J, Williams, GF eds.: Textbook of Diabetes, Blackwell Sci Publ, Oxford, 1991), pp. 84-89.
15. Round, PM, Olsen, KJ, Home, PD: Improved blood glucose control with insulin-analogue B28-Asp. Diabetologia 39 (Suppl.l): A24, 1996.
16. DiMarchi, RD, Trautmann, ME: Insulin lispro: Molekularstruktur und biologische Wirkungen. Diab Stoffwechsel 5: 113-6, 1996.
17. Buelke-Sam, J, Byrd, RA, Hoyt, JA, Zimmermann, JL: A reproductive and developmental toxicity study in CD rats of Ly275585, (LysB28,ProB29)-human insulin. J Amer Coll Toxicol 13: 247-260, 1994.
18. Shojaee-Moradie, F: Novel relatively hepatoselective insulin-analogues. Diabetologia 36 (Suppl.l): A30, 1993
19. Jorgensen, S, Vaag, A, Langkjaer, L: Novosol Basal: pharmacokinetics of a novel soluble long acting insulin-analogue. Br Med J 299: 415-419, 1989.
20. Seipke, G, Geisen, K, Neubauer, HP, Pittins, C, Rosskamp, R, Schwabe, D: New insulin preparations with prolonged action profiles: A21-modified arginine insulins. Diabetologia 35(Suppl.l): A4, 1992.
21. Talaulicar, M, Willms, B, Rosskamp, R: HOE 901, ein neues Insulinanalogon, zur Substitution des basalen Insulinbedarfs bei Typ-I-Diabetes. Diab Stoffwechsel 5:3-6, 1996.