Erzsébet Kórház I. Belgyógyászat, Diabetes Szakambulancia,
Sopron
A HAEMOSTASIS ELTÉRÉSEI
Becher Péter dr., Erényi Ottó dr., Vaslaki Lajos dr.
Összefoglalás
A haemostasis eltérései a legtöbb endokrin megbetegedésben
megfigyelhetök. 71 nem-inzulin-dependens diabetes mellitusos (NIDDM), 16 csökkent
glukóztoleranciájú (IGT) beteg haemostasisparamétereit hasonlítottuk össze 15
egészséges kontroll személy értékeivel. A fibrinogén szintje diabetesben és IGT-ben
is szignifikánsan magasabbnak bizonyult, mint a kontroll személyeknél (DM: 3,8, IGT:
3,55, kontroll: 2,76 g/l). Hasonló megoszlást tapasztaltunk a plazma viszkozitásánál
(1,37 vs 1,27 vs 1,20 mPas), valamint a teljes vér viszkozitásának esetében is (4,50
vs 4,06 vs 3,40 mPas). A thrombocyták száma NIDDM-ben nagyobb, mint IGT-ben és
egészséges személyeknél (338 vs 276 vs 281 ezer/µl). Diabetesben a thrombocyták
mérete is megnő (9,85 vs 8,30 vs 8,21 fl). A vérlemezkék maximális aggregációja
cukorbetegeknél ristocetin (81,6 vs 72,9 vs 74,0%), valamint kollagén (78,5 vs 68,0 vs
69,0%) jelenlétében
fokozott. Adenozin-difoszfát jelenlétében ilyen eltérés nem észlelhető (76,0 vs
70,4 vs 73%). Korreláció figyelhető meg a hemoglobin A1- érték és a fibrinogénszint
(korrelációs együttható: 0,96), illetve a ristocetin kiváltotta adhézió között
(0,89). Összefüggést találtunk a cholesterinszint és fibrinogénszint (0,83),
valamint a cholesterin és a thrombocyta-adhézió (0,84) viszonylatában is.
Eredményeink felhívják a figyelmet a haemorrheologiai eltérések jelentőségére
szénhidrátanyagcsere-betegségek szövődményeinek kialakulásában.
Kulcsszavak: NIDDM, IGT,
haemostasis, thrombocyta-aggregáció
Haemostatic anomalies in disorders of
carbohydrate metabolism
Summary
There have been reports on haemostatic
disorders in endocrine diseases. The rapid development of techniques during the past 10
years has enabled to investigate the haemostatic abnormalities in diabetes mellitus. We
compared the parameters of 71 patients with NIDDM and 16 with impaired glucose tolerance
(IGT) with 15 control persons. Higher fibrinogen levels were measured in diabetes and IGT
(NIDDM: 3.8, IGT: 3.55, control: 2.76 g/l). In these groups both the plasma viscosity
(1.37 vs 1.27 vs 1.20 mPas) and the blood viscosity was altered (4.50 vs 4.06 vs. 3.40
mPas). The platelet count (338000 vs 276000 vs 281000/µl) and the mean platelet volume
(MPV) were increased in diabetes (9.85 vs 8.30 vs 8.21 fl). The maximal platelet adhaesion
induced by ristocetin was faster in NIDDM, than in IGT and in control subjects (81.6 vs
72.9 vs 74 %). It could be stated that the aggregation by collagen was increased in
diabetes (78.5 vs 68.0 vs 69.0%). There was no difference in the platelet aggregation
induced by adenosin- diphosphate between the groups (76 vs 70.4 vs 73%). It was
established, that there is a strong correlation between haemoglobin A1- level and fibrinogen, as well
between HBA1-level and platelet aggregation
(correlation: 0.96 and 0.89). The present investigation provides evidence for the role of
haemostatic disorders in the development of diabetic complications.
Key words: NIDDM, IGT,
haemostasis, platelet aggregation
A haemostasis anomáliái a legtöbb endokrin betegségben megfigyelhetök.1 A szénhidrátanyagcsere-zavarokban
tapasztalható haemostaseologiai eltérésekkel számos, egymásnak több ponton
ellentmondó közlemény foglalkozik. Klinikai tanulmányok szerint csak kevéssel nagyobb
a jól beállított diabeteses betegeknél tapasztalható thromboemboliás megbetegedések
gyakorisága, mint egészséges egyének körében.2 egyértelműen gyakrabban fordulnak
elő ezek a szövődmények kisiklott anyagcsere esetén, így például diabeteses
hyperosmolaris kómában. Ezen komplikációk elsősorban az artériákat, ritkábban a
vénákat érintik.
A haemorheologiai szerepet játszó sejtes elemek közül csupán a vérlemezkék
eltéréseit sikerült mindeddig igazolni. Magasabb béta-tromboglobulin-szintet, fokozott
thrombocyta-adhéziót találtak, a vérlemezkék arachidonsav-anyagcseréje is
felgyorsult volt.3,4
Ismert, hogy diabeteses betegekben magasabb a fibrinogén, a VII. és a VIII.
alvadási faktor szintje. Ezzel párhuzamosan csökken a fibrinolízis, alacsonyabb a
protein C és S koncentrációja.5,6 Mindezek az véralvadás és az
alvadék feloldásának kényes egyensúlyát a thrombosis irányába tolják el.
A DCCT tanulmány inzulin-dependens (IDDM) cukorbetegeken igazolta, hogy
kielégítő glykaemiás kontrollal a diabetes szem-, vese- és idegrendszeri
szövődményeinek kockázata csökkenthető. 7 Nem-inzulin-dependens diabetesre
vonatkozó ismereteket az Egyesült Királyságban most zajló vizsgálatsorozat adhat.8
Kevés adat áll rendelkezésre arról, hogy a diabetesben megfigyelhetö
haemostaseologiai abnormalitások mennyiben függenek a vércukorszinttöl, és mennyiben
tekinthetök a multimetabolikus szindróma részjelenségének.
Célunk az volt, hogy a plazmatikus és sejtes haemorheologiai elváltozásokat
meghatározzuk csökkent glukóztolerancia, valamint manifeszt NIDDM esetén is.
Összefüggést kerestünk az anyagcserehelyzetre utaló hemoglobin A1-érték, illetve a
haemostasis-paraméterek között.
Betegek és módszerek
Diabetes szakambulanciánkon frissen jelentkezett 71 NIDDM-es, valamint 16
csökkent glukóztoleranciájú beteg haemostasis-paramétereit hasonlítottuk össze 15
egészséges kontroll személy értékeivel.
Az NIDDM-es betegek közül 58 nő (82%), 13 férfi volt (18%). Az IGT-sek között
8 férfi és 8 nöbeteg volt (50–50%). A klasszifikáció a WHO kritériumainak
megfelelően történt.9
Sysmex K-1000 készülék (Müller, Ausztria) segítségével meghatároztuk a
thrombocyták számát. A vörösvértesteknél használt átlagos sejttérfogat (MCV)
analógiájára kiszámoltuk a thrombocyták átlagos térfogatát (mean platelet volume,
MPV).
CARAT TX 4 készüléken (Carat, Budapest) megmértük a vérlemezkék maximális
adhézióját 1,5 mg/ml koncentrációjú ristocetin jelenlétében (ennek értékét
százalékban adtuk meg thrombocyta-szegény plazmához viszonyítva, egészségesekben
60-80%). Meghatároztuk a thrombocyták aggregációját 1,6 µg/ml kollagén, valamint 10
µg/ml adenozin-difoszfát (ADP) mellett is (a normáltartomány kollagénnél 60-80%,
ADP-nél 70-90%).
A plazma fibrinogénszintjét is megállapítottuk (normálérték 1,7-3,0 g/l).
Hevimet 40 capillar viszkoziméter (Hemorex, Budapest) segítségével megmértük a
plazma, valamint 90 1/s grádiens mellett a teljes vér viszkozitását is. Egészséges
személyeknél a plazma viszkozitása 1,15-1,30 mPas, a teljes vér viszkozitása 3,5-4,5
mPas.
Az anyagcsereállapot meghatározására a hemoglobin A1-értéket alkalmaztuk (Schiapparelli
Biosystems Inc. reagensével, normálérték 4,8-7,8%). A cholesterin szintet OLYMPUS
készülékkel mértük meg.
A csoportok közti eltéréseket kétmintás t-próbával elemeztük. Amennyiben
külön nem jelöltük, szignifikánsnak a 0,01-nél kisebb p értéket tekintettük.
A statisztikai elemzéshez korrelációanalízist is használtunk.
Eredmények
A thrombocyták vizsgálata során kapott eredményeinket az 1. táblázatban tüntettük
fel. A thrombocyták számát NIDDM-ben nagyobbnak találtuk, mint IGT-ben és
egészséges személyek között. Diabetesben a vérlemezkék mérete is megnő.
| NIDDM | IGT | kontroll | |
| fibrinogén g/l | 3,8 | 3,55 | 2,76 |
| (0,59)# | (0,54)# | (0,46) | |
| plazma- | 1,37 | 1,27 | 1,20 |
| viszkozitás mPas | (0,26)# | (0,24)# | (0,19) |
| teljesvér- | 4,50 | 4,06 | 3,40 |
| viszkozitás mPas | (0,72)# | (0,54)# | (0,58) |
A thrombocyták maximális adhéziója, illetve aggregációja cukorbetegekben
ristocetin, valamint kollagén jelenlétében fokozott. Adenozin-difoszfát jelenlétében
ilyen eltérés nem észlelhető.
A teljes vér, illetve plazma viszkozitását, illetve a fibrinogénszintet a 2.
táblázatban mutatjuk be. A fibrinogén szintje diabetesben és IGT-ben is
szignifikánsan magasabbnak bizonyult, mint a kontroll személyeknél. Hasonló
megoszlást tapasztaltunk a plazma, valamint a teljes vér viszkozitásának esetében is.
| NIDDM | IGT | kontroll | |
| thrombocyták száma ezer/µl |
338 (36)# |
276 (34) |
281 (46) |
| thrombocyták átlagos mérete (MPV) fl |
9,85 (0,52)# |
8,30 (0,49) |
8,21 (0,39) |
| thrombocytadhézió 1,5 mg/ml ristocetin % |
81,6 (6,9)# |
72,9 (11,6) |
74,0 (14,2) |
| thrombocyták aggregációja 1,6 µg/ml kollagén % |
78,5 (8,6)# |
68,0 (7,5) |
69,0 (11,4) |
| thrombocyták aggregációja 10 µg/ml ADP % |
76,0 (9,5) |
70,4 (8,5) |
73 (9,2) |
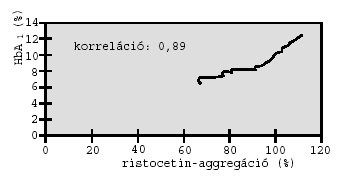
A vércukorszint és a haemostasis eltérései közötti összefüggést keresve
korrelációt számítottunk az aktuális HbA1-érték, valamint a
fibrinogénszint, a teljes vér viszkozitása és a ristocetin kiváltotta adhézió
között (1–2. ábra). A glikált hemoglobin szintje és a fibrinogénszint
között a korrelációs együttható értéke 0,96, ami kifejezett összefüggésre utal.
A fibrinogénszint a HbA1-érték
növekedésével emelkedik. A HbA1 és a ristocetin
kiváltotta thrombocyta-adhézió közti kapcsolat 0,89, ez erős korrelációt jelez.
Megfigyelhető, hogy normális HbA1-tartományban
thrombocyta diszfunkció még nincs, ez csak tartósan magasabb vércukorértékeknél
jelenik meg. A teljes vér viszkozitása és HbA1 közötti kapcsolat
gyenge (0,65).

1. ábra: A hemoglobin A1-érték és a ristocetin kiváltotta thrombocyta-adhézió összefüggése.
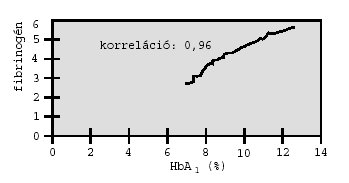
2. ábra: A hemoglobin A1-érték és a fibrinogénszint összefüggése.
A cholesterin szint és fibrinogén között
erős, 0,83 a korreláció. Az össz-cholesterin szint és ristocetin-adhézió közötti
viszonylatban a korrelációs együttható értéke magas, 0,84.
Megbeszélés
Irodalmi adatok szerint nem rendezett
anyagcsereállapotú diabetesben nagyobb a thromboemboliás szövődmények kockázata. Virchow
klasszikus elképzelése szerint a vérrögképződésnek három oka lehet: a
lelassult véráramlás, az érfal, illetve a vér elváltozása.
Rosszul beállított diabetes esetén a
postoperatív szövődmények gyakoribbak, a kórházi ápolási idő hosszabb, így az
immobilizációs thrombosisra is nagyobb az esély. Diabetesben a macroangiopathia
gyakorisága ismert. Munkacsoportunk a thrombosishoz vezető haemostaseologiai
eltéréseket vizsgálta mind a vér sejtes elemeinél, mind pedig a vérplazmában. A
ristocetin szintetikus antibiotikum, mely a von Willebrand-faktor intermedier
multimerjeinek indirekt kimutatására használható. Fokozottnak találtuk a ristocetin
kiváltotta vérlemezke-adhéziót NIDDM-ben. Diabeteses betegeink között a kollagén
mediálta aggregáció nagyobb mérvű. A kalciumbeáramlás fokozása útján ható ADP
kiváltotta aggregáció nem különbözött a csoportokat összehasonlítva.
Jelen vizsgálatunk eredményei szerint a thrombocyták számában, méretében és
aggregációs tulajdonságaiban eltérést csak manifeszt diabeteses betegeink esetén
láttunk. A thrombocyta-aggregáció fokozódása csak a normálistól eltérő hemoglobin
A1-érték esetén volt
megfigyelhető. Ezek az adatok azt sugallják, hogy a thrombocyták diszfunkciója
vércukorszintfüggő lehet. Ennek mechanizmusa ma még jórészt ismeretlen.
Kézenfekvő, hogy vérlemezkék membránfehérjéinek nem enzimatikus glikációja
állhat a háttérben, de bizonyos tanulmányok ezt az elképzelést cáfolják.10
Elképzelhető az is, hogy a thrombocyták átlagos mérete is a glikáció miatt
nagyobb. Irodalmi adatok szerint a nagyobb méretű vérlemezkék fiatalabbak,
aggregációs tulajdonságaik fokozottak.
Általában ilyen éretlen sejtek a felgyorsult csontvelöi anyagcsere
következtében kerülnek a perifériára, mint azt például hyperthyreosisos betegeknél
is láthatjuk.1
A vérlemezkék aggregációját az inzulin gátolja. IDDM-ben az inzulinhiánnyal
magyarázzák a vérlemezkék aktivitásának fokozódását.11 Ez a mechanizmus nem-inzulin-dependens
cukorbetegekben bizonyosan nem játszhat jelentős szerepet, hiszen NIDDM-ben alapvetően
hyperinsulinismus áll fenn.
A microangiopathia hátterében a nem enzimatikus glikáció föszerepet játszhat,
de az utóbbi időben az oxidatív behatásoknak, valamint az endothelium eredetű
relaxáló faktor (EDRF–NO) csökkenésének is fontos jelentőséget tulajdonítanak.
Microangiopathia esetén a plazma von Willebrand-faktorának szintje emelkedik, ennek
pedig a vérlemezke-adhézió fokozódása egyenes következménye. 12 Más adatok szerint a thrombocyták
aktivációja az elsődleges (béta-thrombomodulinszint emelkedése). Továbbra sem
tisztázott tehát, hogy a thrombocyták diszfunkciója, avagy az endothel
károsodásának szerepe a döntő a primer haemostasis eltéréseinek hátterében.
A thrombocytákat vizsgálva tehát mind a vérlemezkék relatíve nagyobb száma,
mind pedig a fokozott adhéziós–aggregációs tulajdonságok felelősek lehetnek a
diabeteses betegben tapasztalt thrombophiliáért.
Adatainkból arra következtethetünk, hogy a vérlemezkék működési zavarai
megelőzhetök, ha betegeinknél sikerül a normoglykaemiát elérni.
A plazma vizsgálata során talált eltérések, így a magasabb fibrinogénszint,
az emelkedett plazma- és teljesvér-viszkozitás mind csökkent glukóztoleranciában,
mind pedig diabetesben megfigyelhetök. Korrelációs vizsgálatok szerint a fibrinogén
értéke szoros összefüggésben van a glikohemoglobin arányával. Ezek az eltérések
már a diabetes manifesztációja előtt megjelennek, s a metabolikus X-szindróma
részének tekinthetök.
Nem tisztázott az, hogy a fibrinogén milyen strukturális eltérése társul a
diabeteses anyagcserezavarhoz. Nem tudjuk azt sem, hogy a teljes vér viszkozitásának
fokozódásában mekkora szerepet játszik az erythrocyták membránjának, illetve a
hemoglobinnak a glikációja.
Ismert azonban az, hogy már korán csökken a fibrinolízis aktivitása,
elsősorban a plazminogénaktivátor-inhibitor I (PAI-I) szintjének fokozódása, illetve
a plazminogén-aktivátor (tPA) csökkenése miatt.
Bár az eredmények ellentmondásosak, kiemelkedő fontosságúnak látszik a nem
enzimatikus glikáció szerepe, amely a legtöbb diabeteses szövődmény patogenezisének
alapja. Haemorheologiai szempontból elsörendű szerepe van a glikált LDL
kialakulásának (macroangiopathia), valamint az előrehaladott glikációs
végtermékeknek (AGE). Ez utóbbiak lehetnek az endothel diszfunkciójának okai.
Eredményeink közelebb visznek a diabeteses thrombophilia patogenezisének
megértéséhez, mely összetett: mind a thrombocyták anomáliái, mind a vérplazma
eltérései oki szereppel rendelkeznek. Vizsgálatunk eredményeit, valamint a DCCTböl
levonható következtetéseket felhasználva állíthatjuk: a haemostasis
rendellenességei mind IGTben, mind pedig NIDDM-ben megelőzhetök, amennyiben
kielégítő anyagcserekontrollt tudunk biztosítani.13,14,15 Elengedhetetlennek látszik
cukorbetegeink haemorheologiai gondozása. A thrombocyta-aggregáció gátlószereivel
végzett vizsgálatok eredménye kiábrándító: nem vált be sem az aspirin, sem az
aspirin-dipyridamol kombináció.
A retinopathia megelőzésében, progreszsziójának lelassításában a
ticlopidinnek lehet a jövöben némi szerepe. Az orális antidiabetikumok közül a
gliclazid javítja a vérlemezkék működését, normalizálja a felborult
prosztaglandin-egyensúlyt, növeli a szöveti plazminogén-aktivátor szintjét, s így
csökkenti a retinopathia kockázatát és progresszióját.16,17 Szegényes terápiás lehetőségeink
miatt hemorheologiai eltérések esetén tehát a normoglykaemia elérésére kell
törekednünk, más módszerek hatásfoka ma még csekély.
IRODALOM
1. Becher P., Erényi O. és Vaslaki
L.: A haemostasis eltérései pajzsmirigybetegeinknél Magy Belorv Arch 51: 1998.
(közlés alatt)
2. Udvardy M.: Diabetes mellitus
és haemostasis, rheologia.(in: Halmos T., Jermendy Gy. (szerk): Diabetes mellitus.
Medicina, Budapest. 1997. pp 511-521)
3. Halushka, P. V.: Increased
platelet arachidonic acid metabolism in diabetes mellitus. Diabetes 30: 44-58, 1981.
4. Udvardy M., Torok I., Rák K.: Plasma
thromboxane and prostacyclin metabolite ratio in atherosclerosis and diabetes mellitus.
Thromb Res 47: 479-484, 1987.
5. Ceriello, A.: Coagulation
activation in diabetes mellitus, the role of hyperglycaemia and therapeutic prospects.
Diabetologia 36: 1119-1126, 1993.
6. Colwell, J. A.: Vascular
thrombosis in type II diabetes mellitus. Diabetes 42: 8-13, 1993.
7. Diabetes Control and
Compliacations Rial Research Group: The effect of intensive treatment of diabetes on
the development and progression of long term complications in insulindependent diabetes
mellitus. N Eng J Med 329: 977-986, 1993.
8. UK Prospective Diabetes Study
Group: UK. Prospective Diabetes Study 16. Overview of 6 years’ therapy of type II.
diabetes Diabetes 44: 1249-1258, 1995.
9. WHO Study Group: Prevention
of diabetes mellitus, Techn Rep Ser 844. WHO Geneva, 1994.
10. Yatscoff, R.W., Mehta, A.,
Gerrard, J. M., Thlivers, J: Glycation of platelet protein in diabetes mellitus, lack
of correlation with platelet function Clin Biochem 20: 359-363, 1993.
11. Vlassara, H.: Recent
progress on the biologic and clinical significance of advanced glycosylation endproducts J
Lab Clin Med 124: 19-28, 1994.
12. Mayne, E. E., Bridges, J. M.,
Weaver, J.: Platelet adhesiveness, fibrinogen and factor VIII. levels in diabetes
mellitus Diabetologia 6: 436-445, 1980.
13. Ohkubo, Y., Kishikawa, H.,
Araki, E.: Intensive insulin therapy prevents the progression of diabetic
microvascular complications in Japanese patients with non-insulindependent diabetes
mellitus Diab Res Clin Pract 28: 103-117, 1995.
14. Reichard, P., Nilsson, B. Y.,
Rosenquist, U.: The effect of long-term intensified insulin treatment on the
development of microvascular complications of diabetes mellitus. N Engl J Med 329:
304-309, 1993.
15. Gaster, B., Hirsch, IB.: The
effect of improved glycemic control on complications in type 2 diabetes. Arch Intern Med
158: 134-141, 1998.
16. Akanuma, Y., Kosaka, K.,
Kanazawa, Y., Kazuga, M., Fukada, M., Aoki, S.: Long-term comparison of oral
hypoglycemic agents in diabetic retinopathy: gliclazide vs other sulphonylureas. Diab Res
Clin Pract 5: 81-90, 1988.
17. Fu, ZZ., Yan,
T., Chen, YJ., Sang, JP.: Thromboxane/prostacyclin balance in type II diabetes:
gliclazide effects Metabolism 41 (5) suppl. 1: 33-35, 1992.