
Haynal Imre Egészségtudományi Egyetem, Orvostovábbképző Kar, II. Gyermekgyógyászati Tanszék és Borsod-Abaúj-Zemplén Megyei Kórház, Gyermekegészségügyi Központ, Miskolc1, Semmelweis Orvostudományi Egyetem, I. Belgyógyászati Klinika, Budapest2
A PUBERTÁS SZEREPE A DIABETES MELLITUS SZÖVÖDMÉNYEINEK KIALAKULÁSÁBAN
Barkai László dr.1, Kempler Péter dr.2, Mazsaroff Csilla dr.1, Fehér Annamária dr.1, Vámosi Ildikó dr.1
Összefoglalás
A jelen munka célja annak vizsgálata volt, hogy a serdülőkor önálló rizikótényezőnek tekinthetö-e a diabeteses szövődmények preklinikai formái vonatkozásában. A szerzők 112 inzulin-dependens diabeteses beteg adatait elemezték, akiken vizsgálták a persistaló microalbuminuriát, a cardiovascularis autonom neuropathiát, a perifériás sensoros neuropathiát és a preklinikai retinopathiát. Az anyagcserekontroll megítélésére a glikált hemoglobin értékeket, a pubertás vizsgálatára a Tanner-stádiumokat alkalmazták. A vizsgált betegekben a persistaló microalbuminuria 14,0%, a preklinikai retinopathia 16,0%, a perifériás sensoros neuropathia 21,3% és az autonom neuropathia 22,0% gyakoriságú volt. A diabetestartam és a HbA1c mellett a késői pubertás stádiumok a microalbuminuria (p=0,04) és a perifériás neuropathia vonatkozásában (p=0,02) független prediktív tényezőknek bizonyultak. Az eredmények amellett szólnak, hogy a pubertás önálló rizikótényezőként szerepelhet bizonyos szövődmények vonatkozásában, illetve a betegség tartama és a rossz anyagcserekontroll mellett a serdülés folyamata is szerepet játszhat a perifériás neuropathia és a microalbuminuria patogenezisében.
Kulcsszavak: IDDM, gyermekek és serdülők, szövődmények
Role of puberty in the development of diabetic complications
Summary
The aim of the present study was to investigate whether puberty is an independent risk factor for preclinical complications of diabetes. Data of 112 insulin dependent diabetic patients were analized in whom persistent microalbuminuria, cardiovascular autonomic neuropathy, peripheral sensory neuropathy and preclinical retinopathy were assessed. Glycaemic control was estimated by glycated haemoglobin measurements and puberty was characterized by Tanner staging. Persistent microalbuminuria was observed in 14.0%, preclinical retinopathy in 16.0%, peripheral sensory neuropathy in 21.3% and autonomic neuropathy in 22.0% of patients studied. In addition to diabetes duration and HbA1c level, advanced puberty proved to be independent predictive variable for persistent microalbuminuria (p=0.04) and peripheral neuropathy (p=0.02). It is concluded that, besides diabetes duration and metabolic control, puberty represents an independent risk for certain complications of diabetes and pubertal milieu could be involved in the pathogenesis of peripheral neuropathy and microalbuminuria.
Key words: IDDM, children and adolescents, complications
Az elmúlt évtizedben az orvostudománynak a diabetológiával kapcsolatos ismeretei számottevően gyarapodtak, ennek következtében elsősorban az alapbetegség kezelésének feltételei javultak. Bár a szövődmények vonatkozásában is intenzív kutatások folynak, az eddigi új megismerések nem hoztak átütő sikereket, ezért ma még döntöen a szövődmények kialakulása befolyásolja a betegek életminőségét és várható élettartamát.
A gyermek- és serdülőkori endokrin- és anyagcsere-megbetegedések leggyakoribb formája az inzulinhiányos (inzulin-dependens vagy 1. típusú) cukorbetegség, melynek incidenciájában az elmúlt évtizedben hazánkban is számottevő emelkedést észleltünk.1 A gyakoriság növekedése mellett azt is tapasztalhatjuk, hogy a betegség egyre fiatalabb életkorban manifesztálódik, aminek következtében egyes betegek a pubertás elérésekor már több mint tíz éves betegségtartammal rendelkeznek.
Ismert, hogy a szövődmények kialakulása már a gyermekkorban elkezdödik,2 és mai ismereteink szerint a cukorbetegek közül a gyermekek életkilátásai a legkedvezötlenebbek.3 Korábbi, elsősorban epidemiológiai megfigyelések alapján felmerült, hogy a pubertáskorban bekövetkező endokrin változások felgyorsítják a szövődmények kifejlődését,4,5,6 ezért jelen munkánkban célul tüztük ki annak vizsgálatát, hogy a serdülőkor önálló rizikótényezőnek tekinthetö-e a diabetes mellitus preklinikai microangiopathiás és neuropathiás szövődményei vonatkozásában.
Beteganyag és módszer
Vizsgálatunkban 112 (49 fiú, 63 leány) cukorbeteg gyermek és serdülő eredményeit értékeltük. A betegek kiválasztása az alábbi szempontok szerint történt:
A betegek életkora 7–19 év között (átlag±SD: 14,3±3,4 év), betegségük időtartama 2–14 év között (6,4±2,5 év) váltakozott. A betegek kezelését naponta 2–5 alkalommal adott rövid és intermedier hatású humán inzulinnal végeztük. Az étrendi kezelés 3 fő és 3 kisétkezés formájában, az életkor, testsúly és a nem szerint megállapított össz-kalórián belül 25–30% zsír, 15–20% fehérje, 55–60% szénhidrát ajánlásán alapult. A betegek rendszeres oktatását orvos, szakasszisztens és dietetikus által alkotott munkacsoport végezte. Minden beteg esetében a fizikális vizsgálatkor az antropometriai adatok és a vérnyomásértékek rögzítése mellett meghatároztuk a pubertás stádiumát Tanner szerint (T1–5).7
A preklinikai microangiopathia és a neuropathia vizsgálatára az alábbi módszereket alkalmaztuk:
1. A nephropathia vizsgálatát 24 órás gyűjtött vizeletböl az albumin excretiós ráta mérésével végeztük (Abbott Turbox Microalbuminuria Assay). A vizeletgyűjtés odahaza történt, a betegeket kioktattuk arra, hogy a gyűjtés ideje alatt a szokásost meghaladó fizikai aktivitást kerüljék. A vizsgálatot pozitívnak tekintettük (persistaló microalbuminuria, illetve incipiens nephropathia), amennyiben legalább két egymást követő alkalommal (6–8 hetes idöközzel) az albuminürítés meghaladta a 20 µg/perc értéket.
2. A retinopathia vizsgálatára fluoreszcens angiográfiát alkalmaztunk. 10%-os Na-fluoreszcein intravénás beadása után sorozatfelvételek készültek, melyek kiértékelése Malone stádiumbeosztása alapján történt.8 A szemfenéki képet pozitívnak tekintettük (preklinikai retinopathia), amennyiben a Malone szerinti stádium =1 volt.
3. A perifériás neuropathia vizsgálatát kvantitatív sensoros teszt segítségével, az áramérzet-küszöb meghatározásával végeztük (Neurometer, Baltimore). Az ingerlés során a három fő rostféleségnek (A-beta, Bd, C) megfelelően három különböző frekvenciát alkalmaztunk (2000 Hz, 250 Hz és 5 Hz) a n. medianus és a n. peroneus területén.9 Pozitívnak tekintettük a vizsgálatot (hypaesthesia) akkor, ha legalább egy vizsgálati paraméter esetében kórosan emelkedett áramérzet-küszöböt észleltünk.10
4. Az autonom neuropathia vizsgálatára cardiovascularis teszteket alkalmaztunk, melynek során vizsgáltuk
A szívfrekvenciák meghatározását EKG-vel (Medicor ER 31–A) az R–R távolságok alapján, a vérnyomás mérését oszcillometriás (OMRON HEM–400 C) vérnyomásmérö készülékkel végeztük. Pozitívnak tekintettük a vizsgálatot amennyiben legalább két vizsgálati paraméter kórosnak bizonyult.11
A vizsgálatban szereplő betegek közül 107-nél végeztünk mikroalbumin-meghatározást, 50-nél fluoreszcens angiográfiát, 108-nál áramérzetküszöb-vizsgálatot, 109-nél értékeltük a cardiovascularis teszteket. Az anyagcserekontroll megítélésére a háromhavonta mért glikált hemoglobin (HbA1c) összes értékeinek átlagát határoztuk meg (IMx Glycated Hemoglobin Assay, Abbott). A nem diabeteses normális érték felső határa: 6,4%. A vérzsírok (cholesterin, triglycerid) vizsgálata 6–12 havonta, rutin laboratóriumi módszerekkel történt.
Az adatok statisztikai értékelését multiplex logisztikus regresszióanalízissel végeztük. A modellben függő változóként az illető szövődmény jelenléte vagy hiánya került, független változóként a diabetestartam (>7 év), a HbA1c (>10%), a pubertás (T4–5), a nem, az inzulindózis (>1,2 E/kg/die), a cholesterin (>5,5 mmol/1), a triglycerid (>2,2 mmol/1), a systolés vérnyomás (>120 Hgmm), a diastolés vérnyomás (>75 Hgmm) és a testmagasság (>75 percentil) szerepeltek. Az önálló rizikó kifejezése a korrigált odds ratio (OR) és a 95% konfidencia-intervallum (CI) megadásával történt.
Eredmények
A vizsgált betegekben a persistaló microalbuminuria gyakorisága 14,0%-osnak (15/107) bizonyult, szemfenéki eltérést 16,0%-ban (8/50) észleltünk.
A perifériás sensoros idegrendszer károsodása 21,3%-ban (23/108) volt kimutatható, míg az autonom idegrendszer működészavara 22,0%-os (24/109) gyakorisággal fordult elő (1. ábra). Betegeinkben – a szelekciós kritériumok alapján is – macroalbuminuria, proliferatív retinopathia, illetve klinikai neuropathia nem volt kimutatható.
Mindegyik szövődményt együttesen vizsgálva (bármely szövődmény jelenléte vagy hiánya) a betegség időtartamának növekedése, a magasabb HbA1c-érték és a pubertás késői stádiumai (T4–5) szignifikánsan növelték a szövődmények együttes jelenlétének a kockázatát (p=0,001).

1. ábra: A microangiopathiás és neuropathiás szövődmények gyakorisága a vizsgált betegkben.
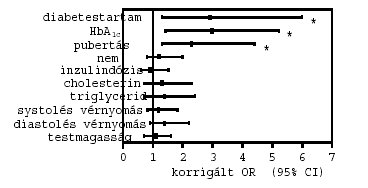
2. ábra: A persistaló microalbuminuria rizikótényezői a vizsgált betegekben. *p<0,05
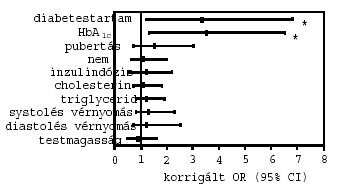
3. ábra: A preklinikai retinopathia rizikótényezői a vizsgált betegekben. *p<0,05
A persistaló microalbuminuriával összefüggésben a hosszabb diabetestartam [OR (95% CI): 2,9 (1,3–6,0); p=0,03)], a magasabb HbA1c [2,9 (1,4–5,2); p=0,02] és a pubertás késöi stádiumai [2,3 (1,3–4,4); p=0,04] bizonyultak szignifikáns, független rizikótényezőknek (2. ábra). A preklinikai retinopathia vonatkozásában a hosszabb diabetestartam [3,3 (1,2–6,8); p=0,01)] és a magasabb HbA1c [3,5 (1,3–6,5); p=0,01] voltak a legjelentősebb rizikótényezők (3. ábra). A perifériás sensoros neuropathia szignifikáns rizikótényezői a magasabb HbA1c [3,0 (1,2–5,8; p=0,005], valamint a késői pubertás stádiumok [2,5 (1,2–5,0); p=0,02] voltak (4. ábra). Az autonom neuropathiával kapcsolatosan a hosszabb diabetestartam [2,6 (1,2–4,6); p=0,03)] és a magasabb HbA1c [3,2 (1,2–5,5); p=0,01] bizonyultak szignifikáns rizikótényezőknek (5. ábra). A nemek, az inzulindózis, a cholesterinés triglyceridszintek, a systolés és diastolés vérnyomásértékek, valamint a testmagasság nem mutattak szignifikáns kapcsolatot egyik szövödménnyel sem.
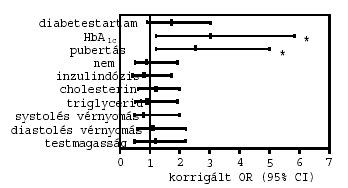
4. ábra: A perifériás neuropathia rizikótényezői a vizsgált betegekben. *p<0,05
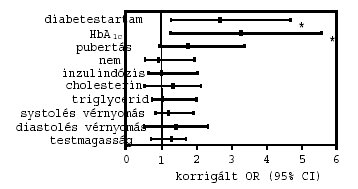
5. ábra: A cardiovascularis autonom neuropathia rizikótényezői a vizsgált betegekben. *p<0,05
Megbeszélés
A diabetes mellitus világszerte népbetegségnek számít, ami a WHO dokumentumai közül legismertebb formában a Saint Vincent-i deklarációban fogalmazódik meg.12 A betegség gyakorisága folyamatosan növekszik, a betegek életminősége közismerten kedvezötlen; mind a morbiditás, mind az idő előtti mortalitás jelentős népegészségügyi problémaként jelentkezik hazánkban is. A diabeteses betegek között a legveszélyeztetettebb az a cukorbeteg populáció amelynek alapbetegsége a gyermekkorban kezdödik.3 Napjainkban a diabeteses gyermekek életkilátásait a szövődmények (micro- és macroangiopathia, neuropathia) kialakulása határozza meg. Mai tudásunk szerint a szövődmények patogenezisében központi szerepet játszik a hyperglykaemia, melynek mértéke, illetve fennállásának időtartama a legfontosabb rizikótényező. 13 A hosszú távú anyagcserehelyzet mellett azonban még számos egyéb tényező (genetikai, endokrin, immunológiai stb. faktorok) szerepe is felmerül, melyek hajlamosító, illetve protektív jelleggel befolyásolhatják a különféle szövődmények kialakulását.14,15,16,17,18 Ezen tényezők megismerése napjainkban intenzív kutatások tárgya.
Jelen vizsgálatban a preklinikai szövődmények gyakoriságát 14–22% közöttinek találtuk, mely megegyezik saját korábbi adatainkkal,10,11 illetve a legújabb nemzetközi irodalmi adatokkal.19,20,21
Bő másfél évtizeddel ezelőtt Barta 5 évnél rövidebb betegségtartamú cukorbeteg gyermekek esetében fluoreszcens angiográfiával 50%-ban mutatott ki szemfenéki elváltozást,2 ezzel szemben a jelenlegi beteganyagunkban ez mindössze 16%-nak adódott. Ezt a nagyfokú gyakoriságcsökkenést a kezelés hatékonyságának (vércukor-monitorozás, többszöri inzulinadagolás, edukáció stb.) az elmúlt időszakban végbement jelentős javulásával magyarázhatjuk, amely a hazai gyermekdiabetológiai gyakorlatot általában jellemzi.22,23
A serdülőkor a diabeteses beteg életében az egyik legkritikusabb periódus, melynek során (élettani és psychés tényezők következtében) szinte törvényszerüen romlik az anyagcserehelyzet, valamint jelentős endokrin-anyagcsere változások zajlanak. Úgy tűnik, hogy ezek a változások önmagukban, illetve komplex módon felgyorsíthatják a szövődmények patogenezisét.24,25 Eredményeink is amellett szólnak, hogy bizonyos szövődmények kialakulása a pubertás alatt – függetlenül az anyagcsere-állapot változásától – felgyorsul, illetve a gyorsabb progresszióért a kedvezötlen anyagcsereváltozásokon kívül, egyéb patogenetikai tényezők is felelőssé tehetök. Néhány szerző szerint a pubertás a retinopathia jelentős rizikótényezője,26,27 mások a nephropathia,5,28 illetve neuropathia29,30 vonatkozásában észleltek hasonló összefüggéseket. A microangiopathia egyik korai morfológiai jele a capillaris basalis membránjának megvastagodása. Tübiopsziás vizsgálatok során a basalis membrán vastagsága és a glikált hemoglobin értéke között a pubertás előtt összefüggést nem lehetett kimutatni, ezzel szemben a serdülőkorban ezen morfológiai paraméter jól korrelált mind az anyagcsere-kontrollal, mind a csontkorral.31 A kisér-károsodás funkcionális jele a vascularis reaktivitás beszűkülése, mely a microcirculatio zavaraként megelőzi a morfológiai elváltozások megjelenését. Lézer Doppler fluximetriával igazolni lehetett, hogy a microcirculatio eltérései prepubertásban lévő diabeteses gyermekekben már fennállnak.32 Saját korábbi vizsgálatainkban a vascularis funkció megítélésére alkalmas transcutan oxigén-meghatározásokkal a nyugalomban mérhető, valamint a lokális ischaemiára bekövetkező transcutan oxigén nyomás változás (reaktív hyperaemia) vizsgálatával diabeteses serdülőkben kimutattuk, hogy a vascularis funkció a pubertás stádiumok növekedésével párhuzamosan romló tendenciát mutat. Ez az összefüggés az anyagcserehelyzettöl függetlenül is igazolható volt.33 Ezek a vizsgálatok arra utalnak, hogy a microangiopathia legkoraibb, csupán funkcionális eltérésekkel jellemezhető szakasza már a pubertás előtt kialakulhat, azonban a patológiai folyamatok felgyorsulásában, illetve a morfológiai eltérések kialakulásában a pubertás szerepet játszhat. Állatkísérletek igazolták, hogy azonos mértékű hyperglykaemia a nemi érés stádiumában lévő állatokban kifejezettebb peripheriás idegrendszeri laesiót okoz, mint felnőtt állatokban.34 Ez amellett szól, hogy a serdülés időszakában az idegrendszer a diabetes károsító hatásaival szemben sérülékenyebb lehet, mint a serdülést megelőző vagy azt követő életkorban.
A jelenlegi vizsgálatunkban a pubertás csak a microalbuminuria és a perifériás sensoros neuropathia tekintetében bizonyult jelentős rizikótényezőnek. Ez felveti annak a lehetőségét is, hogy bizonyos szervek, szövetek (vese, somaticus idegek) a diabetes károsító hatásaival szemben különösen sérülékenyek lehetnek a serdülőkorban.
Az ilyen jellegű következtetések levonásához azonban a jelenlegi keresztmetszeti vizsgálat nem alkalmas, a kérdés megválaszolásához további prospektív, longitudinális vizsgálat szükséges.
Nem ismert, hogy a pubertás milyen mechanizmussal járulhat hozzá a szövődmények kialakulásához. Tekintettel arra a klinikai gyakorlatból jól ismert jelenségre, hogy a pubertás során az anyagcsere általában romlik, kézenfekvönek tűnik, hogy a szövődmények kifejlődésében észlelhető kedvezötlen változásokat pusztán ennek tulajdonítsuk.
Mindazonáltal néhány vizsgálat szerint a microangiopathia gyakorisága a pubertás után ugrásszerüen megnövekszik, ami sem az anyagcsere romlásával, sem a betegségtartam növekedésével nem volt magyarázható.35 Ezek alapján felmerül egyéb, elsősorban endokrin jellegű tényezők szerepe. Állatkísérletes vizsgálatok szerint a nemi hormonoknak szerepük lehet, mivel kimutatták, hogy a diabetes indukálta anyagcsereváltozások (poliol anyagcsere), a vascularis permeabilitás fokozódása és a kollagénglikoziláció szexhormondependens folyamatok.36 A pubertáskori IGF–I (inzulinszerű növekedési faktor–I) és egyéb növekedési faktor termelődés fokozódásának szintén jelentőség tulajdonítható, ugyanis retinopathiás betegekben magasabb IGF–I-szintet mértek, mint a szövődménytöl mentes diabetesesekben.37 Ezt látszanak alátámasztani azok a kísérletes adatok, melyek szerint a szöveti IGF–I és/vagy IGF BP–1 (inzulinszerű növekedési faktor kötöfehérje-1) szintjének elsődleges szerepe van a retinalis angiogenesis, a mesangialis proliferáció, illetve a neuronalis regeneráció vonatkozásában.38,39,40
Összefoglalva elmondhatjuk, hogy a kezelés javulásával a preklinikai diabeteses szövődmények gyakorisága gyermek- és serdülőkorban csökkenthető, azonban a mai korszerű kezelési elvek és módszerek birtokában is mintegy 14–22%-os gyakorisággal kimutatható a microangiopathia, illetve a neuropathia valamilyen kezdeti formája.
A serdülőkorban egyes szövődmények esetében kifejezett romlás várható, ezért a lehető legjobb anyagcserekontrollra törekvő kezelés mellett a szövődmények rendszeres vizsgálata ebben az életkorban elengedhetetlen.
IRODALOM
1. Soltész Gy, Madácsy L, Békefi D, Dankó I and the Hungarian Childhood Diabetes Epidemiology Group: Rising incidence of type 1 diabetes in Hungarian children. Diabetic Med 7: 111–114, 1990.
2. Barta L: The importance of fluorescein angiography in the treatment of juvenile diabetes. Pediatr Adolesc Endocrinol 9: 201–203, 1981.
3. Parving, H-H, Hommel, H, Mathiesen, E: Prevalence of microalbuminuria, arterial hypertension, retinopathy and neuropathy in patients with insulin dependent diabetes. Br Med J 296: 156–160, 1988.
4. Laws, HW, Harpur, ER, Belmonte, MM: A long-term study of retinal changes in the prepuberty and puberty onset diabetics. Can J Ophthalmol 1: 104–11l, 1966.
5. Kostraba, JN, Dorman, JS, Orchard, TJ, Becker, DJ, Ohki, Y, Ellis, D, Doft, BH, Lobes, LA, LaPorte, RE, Drash, AL: Contribution of diabetes duration before puberty to development of microvascular complications in IDDM subjects. Diabetes Care 12: 686–93, 1989.
6. Vincze P, Madácsy L, Brooser G, Barkai L: Cukorbeteg gyermekek és fiatalok retinalis microangiopathiájának alakulása prepubertális és pubertális betegségkezdet esetén. Orv Hetil 133: 2149–2153, 1992.
7. Tanner, JM. Growth at adolescence. Blackwell, Oxford, 1962.
8. Malone, JI, Grizzard, WS, Espinoza, LR, Achenbach, KE, Van Cader, TC: Risk factors for diabetic retinopathy in youth. Pediatrics 73: 756–761, 1984.
9. Kempler P, Keresztes K, Marton A, Hennányi Zs, Vargha P, Tamás Gy: Perifériás sensoros neuropathia átfogó vizsgálata a Neurométer-R segítségével régóta fennálló és frissen felfedezett nem inzulindependens diabetes mellitusban. Magy Belorv Arch 48: 163–167, 1995.
10. Barkai L, Kempler P, Vámosi I, Keresztes K: Current perception threshold in children and adolescents with insulindependent diabetes. Diabetologia 38 (Suppl 1): 236, 1995
11. Barkai L, Madácsy L: Cardiovascular autonomic dysfunction in diabetes mellitus. Arch Dis Child 73: 515–518, 1995
12. World Health Organization (Europe) and International Diabetes Federation (Europej: Diabetes Care and Research in Europe: the St Vincent declaration. Diabetic Med 7: 360, 1990.
13. The DCCT (Diabetes Control and Complications Trial) Research Group: The effect of intensive treatment of diabetes on the development and progression of long-term complications in insulin-dependent diabetes mellitus. N Engl J Med 329: 977–986, 1993.
14. Seaquist, ER, Goetz, FC, Rich, S: Familial clustering of diabetic kidney disease. Evidence for genetic susceptibility to diabetic nephropathy. N Engl J Med 320: 1161–1165, 1989.
15. Greene, DA, Lattimer, SA, Sima, AAF: Pathogenesis and prevention of diabetic neuropathy. Diab Metab Rev 4: 210–221, 1988.
16. Aurell, M, Bjorck, S: Determinants of progressive renal disease in diabetes mellitus. Kidney Int 41 (Suppl 36): S38–42, 1992.
17. Thomas, PK: Growth factors and diabetic neuropathy. Diabetic Med 11: 732–739, 1994.
18. Madácsy L, Szórády I, Sánta A, Barkai L, Vámosi I: Association of microalbuminuria with slow acetylator phenotype in type 1 diabetes mellitus. Child Nephrol Urol 12: 192–196, 1992.
19. Dahlquist, G, Rudberg, S: The prevalence of microalbuminuria in diabetic children and adolescents and its relation to puberty. Acta Paediatr Scand 76: 795–800, 1987.
20. Kernell, A, Dedorsson, I, Johansson, B, Wickström, CP, Ludvigsson, J, Tuvemo, T, Neiderud, J, Sjöström, K, Malmgren, K, Kanulf, P, Mellvig, L, Gjötterberg, M, Sule J, Persson, LA, Larsson, LI. Aman, J, Dahlquist, G: Prevalence of diabetic retinopathy in children and adolescents with IDDM. Diabetologia 40: 307–310, 1997.
21. d’Annunzio, G, Malvezzi, F, Vitali, L, Barone, C, Giacchero, R, Klersy, C, Zanette, S, Lorini, R: A 3-19-year follow-up study on diabetic retinopathy in patients diagnosed in childhood and treated with conventional therapy. Diabetic Med 14: 951–958, 1997.
22. Madácsy L: A gyermekkori diabetes, kitekintés Európába. Forum Medicorum 1: 5–8, 1997.
23. Békefi D: A gyermekkori diabetes ellátásának hazai helyzete. Forum Medicorum 1: 8–10, 1997.
24. Barkai L: Inzulindependens diabetes mellitus és a pubertás. Orvosképzés 70: 30–35, 1995.
25. Danne, T, Kordonouri, O, Hövener, G, Weber, B: Diabetic angiopathy in children. Diabetic Med 14: 1012–1025, 1997.
26. Falck, AAK, Kaar, ML, Laatikainen, LT: Prevalence and risk factors of retinopathy in children with diabetes. A population-based study on Finnish children. Acta Ophthal 71: 901–909, 1993.
27. Faria de Abreu, JR, Silva, R, Cunha-Vaz, JG: The bloodretinal barrier in diabetes during puberty. Arch Ophthal 112: 1334–1338, 1994.
28. Lawson, ML, Sochett, EB, Chait, PG, Balfe, JW, Daneman, D: Effect of puberty on markers of glomerular hypertrophy and hypertension in IDDM. Diabetes 45: 61–65, 1996.
29. Sosenko, JM, Boulton, AJM, Kubrusly, DB, Jagdish, K, Weintraub, BA, Skyler, JS: The vibratory perception threshold in young diabetic patients: Associations with glycemia and puberty. Diabetes Care 6: 605–607, 1985.
30. Olsen, BS, Nir, M, Kjaer, I, Volund, A, Mortensen, HB: Elevated vibration perception threshold in young patients with type 1 diabetes in comparison to non-diabetic children and adolescents. Diabetic Med 11: 888–892, 1994.
31. Rogers, DG, White, NH, Santiago, JV: Glycemic control and bone age are independently associated with muscle capillary basement membrane width in diabetic children after puberty. Diabetes Care 9: 453–459, 1986.
32. Shore, AC, Price, KJ, Sandeman, DD, Tripp, JH, Tooke, JE: Posturally induced vasoconstriction in diabetes mellitus. Arch Dis Child 70: 22–26, 1994.
33. Barkai L, Donaghue, K, Silink, M, Howard, NJ: Autonóm és vascularis funkciók párhuzamos vizsgálata gyermek- és serdülőkorú cukorbetegekben. Diabetologia Hungarica 4: 73–78, 1996.
34. Malone, JI, Lowitt, S, Korthals, JK, Salem, A, Miranda, C: The effect of hyperglycemia on nerve conduction and structure is age dependent. Diabetes 45: 209–215, 1996.
35. Rogers, DG, White, NH, Shalwitz, RA: The effect of puberty on the development of early diabetic microvascular disease in insulin-dependent diabetes. Diabetes Res Clin Pract 3: 39–44, 1987.
36. Williamson, JR, Rowold, E, Chang, K: Sex steroid-dependency of diabetes induced changes in polyol metabolism, vascular permeability and collagen crosslinking. Diabetes 35: 20–27, 1986.
37. Merimee, TJ, Zapf, J, Froesch, ER: Insulin-like growth factors, studies in diabetics with and without retinopathy. N Engl J Med 309: 527–530, 1983.
38. Flyvberg, A, Thorlacius-Ussing, O, Naeraa, R, Ingerslev, J, Orskov, H: Kidney tissue somatomedin C and initial renal growth in diabetic and uninephrectomised rats. Diabetologia 31: 310–314, 1988.
39. Grant, MB, Russell, B, Fitzgerald, C, Merimee, TJ: Insulinlike growth factors in vitreous body: studies in controls and diabetics with neovascularization. Diabetes 35: 416–420, 1986.
40. Bar, RS, Boes, M, Clemmons, DR: Insulin differentially alters transcapillary movement of intravascular IGFBP–1, IGFBP–2 and endothelial cell IGF-binding proteins in the rat heart. Endocrinology 127: 497–499, 1990.