Pécsi Orvostudományi Egyetem, II. Belgyógyászati Klinika és Nephrológiai Centrum
A NEM-ENZIMATIKUS GLIKÁCIÓ SZEREPE AZ ÖREGEDÉS, AZ ATHEROSCLEROSIS ÉS A DIABETESES NEPHROPATHIA PATOFIZIOLÓGIÁJÁBAN ÉS KLINIKAI KÉPÉNEK KIALAKULÁSÁBAN
Wittmann István dr., Wagner Zoltán dr., Wagner László dr., Mazák István dr., Nagy Judit dr.
Összefoglalás
A nem-enzimatikus glikáció jelentős szerepet játszik a diabeteses szövődmények kialakulásában. A glikációval kapcsolatos irodalom nem egységes terminológiája szükségessé teszi a háttérben álló kémiai reakciók megismerését. A glikáció szabadgyök-képződést okoz, ezért a szervezetben oxidatív stresszt indukál. A szervezetet érő oxidatív stressz és a glikáció hatására egyaránt reaktív aldehidek képződnek, amelyek egyformán szövet-toxikusak; ezt a károsodási folyamatot együttesen karbonil stressznek nevezzük. A glikációs végtermékek szövettani mintákban immunhisztológiai eljárással, testnedvekben kompetitív ELISA vagy fluoreszcens spektrometriás módszerrel mutathatók ki. A glikációs termékek szervezetbe történő bejutásának, a szervezetben való keletkezésének és eliminációjának egyensúlya jellemzi az élettani folyamatokat, és ezen egyensúly felborulása a glikációs termékek felszaporodásához vezethet. A glikációs termékek aktuális szintjéböl a diabeteses nephropathia progressziója megjósolható, mennyiségük megemelkedése fontos rizikótényezője az atherosclerosisnak is.
Kulcsszavak: atherosclerosis, diabeteses nephropathia, karbonil stressz, nem-enzimatikus glikáció, öregedés
Role of non-enzymatic glycation in the pathophysiology and clinical picture of aging, atherosclerosis and diabetic nephropathy
Summary
Non-enzymatic glycation plays an important role in the development of diabetic complications. Differences in the terminology of the glycation processes require discussion of these reactions. Glycation induces free radical formation evolving oxidative stress intracellularly. Both, oxidative stress and non-enzymatic glycation cause an overproduction of reactive carbonyls. The name of this process is carbonyl stress. Detection of advanced glycation end products is possible using immunhistology, competitive ELISA and/or fluorescence spectrometry. The balance of intake, production and elimination of glycation products is disturbed in pathophysiological circumstances leading to the increased concentration of them. High level of the advanced glycation end products may predict the progression of diabetic nephropathy, and is a risk factor for atherosclerosis.
Key words: atherosclerosis, diabetic nephropathy, carbonyl stress, non-enzymatic glycation, aging
Rövidítésjegyzék: AGE: előrehaladott glikációs végtermékek (advanced glycation end products); LMW–AGE: kis molekulasúlyú (low molecular weight) AGE; ADP: adenozin-difoszfát; ATP: adenozin-trifoszfát; DNS: dezoxi-ribonukleinsav; Fe 2+ : ferro vas; Fe 3+ : ferri vas; GBM: glomerulus bazális membrán; H2 O2 : hidrogén-peroxid; ICAM–1: intercelluláris adhéziós molekula–1; VCAM–1: vascularis sejt adhéziós molekula–1; I–kB: inhibitor–kB; MAP (kináz): mitogén aktiválta protein; NF–kappaB: nukleáris faktor-kappaB; OH – : hidroxidion; •OH: hidroxil szabad gyök; •O2 – : szuperoxid szabad gyök; p60=OST–48 és p90=80 K–H: macrophag scavanger receptorok; RAGE: AGE-kötő receptor; SOD: szuperoxid-dizmutáz
Definíció
A nem-enzimatikus glikáció a glukóz – enzim által nem katalizált – kovalens kapcsolódását jelenti aminosavak, fehérjék, lipidek és nukleinsavak szabad aminocsoportjához. Az így keletkezett terméket Schiff-bázisnak nevezik, melyböl spontán átrendeződés után először instabil, ún. Amadori-termékek, majd stabil, ún. glikációs végtermékek alakulnak ki. Ez utóbbiakra az angol nyelvű irodalom az „advanced glycation end products” (AGE) elnevezést használja. Az egész folyamatot a táplálkozástudomány terminológiája szerint Maillard-reakciónak nevezzük.
Elözmények
Maillard 1916-ban írta le, hogy aminosavat és redukáló cukrot tartalmazó elegyben barna szín fejlődik ki.1 Ezután hosszú évtizedeken keresztül csak a táplálkozástudománnyal foglalkozók érdeklödtek a jelenség iránt, és kimutatták, hogy a barnulási reakcióban a redukáló cukor a fehérjék aminocsoportjával és má-sodlagosan a guanidinocsoporttal kerül kapcsolatba.2 A barna szín kifejlődésének sebessége függ a redukáló cukor 3 és az aminosav szerkezetétöl is.4 Pentóz és glukóz, valamint lizin és arginin bizonyult a legreakcióképesebbnek. Fény derült arra is, hogy az ételek – pl. a kenyér – ízét és illatát éppen ezek a Maillard-termékek adják.5,6,7 Igazolták, hogy az ételek készítésekor, a Maillard-reakció során, számos aldehid – pl. formaldehid, acetaldehid – képződik.8
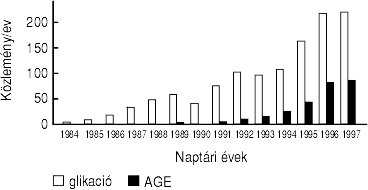
Az orvosbiológiai kutatások a glikációt hosszú idön keresztül, helytelenül, glikozilációként említették. A glikoziláció elnevezés ugyanis mind angolul, mind magyarul a fehérjék poszttranszlációs, enzimatikus módosítását jelöli, amelynek során cukrok épülnek be a fehérjemolekulába. A helyes elnevezést, a glikációt használva, és az AGE kifejezéssel kiegészítve MEDLINE kutatást végeztünk arra vontakozóan, hogy hány közlemény használta ezen utóbbi terminológiákat 1984 és 1997 között (1. ábra). Látható, hogy az irodalomban rohamosan emelkedik a glikációval foglalkozó közlemények száma.
A régi terminológiát használó, korai közlemények közül kiemelendök a haemoglobinnal foglalkozók. Oszlopkromatográfiával minor haemoglobin-frakciókat (HbA1a , HbA1b , HbA1c ) találtak az ötvenes évek végén.9 A hatvanas évek végére biztossá vált, hogy a HbA1c megegyezik a haemoglobin glikációs termékével, az ún. diabeteses haemoglobinnal.10

1. ábra: A MEDLINE által nyilvántartott glikációval és eörehaladott glikációs végtermékekkel foglalkozó cikkek száma a naptári évek szerint
A nem-enzimatikus glikáció kémiája
A nem-enzimatikus glikáció (2. ábra) a már említett Schiff-bázis képződéssel indul.11 Feltételezhető, hogy a glikáció megindulását a glukózmolekula aktivációja elözi meg.12 Ennek során a glukóz szabad gyökké alakul, amely reaktívabb, mint a kiindulási molekula. Az emberi szervezetben zajló glikáció a proteinek és az aminosavak esetében elsősorban a lizin és az arginin módosulását jelenti. A Schiff-bázisból, molekulán belüli átrendeződések után, közti termékek, ún. Amadori-termékek képződnek (2. ábra). A molekula továbbalakulása enediol létrejöttét eredményezi.
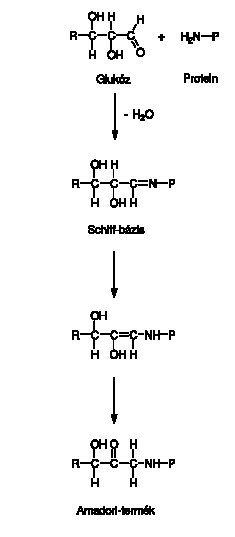
2. ábra: A nem-enzimatikus glikáció lépései a Schiff-bázistól az Amadori-termék képződéséig. (P–NH2=protein szabad aminocsoportja)
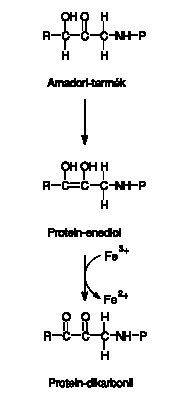
3. ábra: A Maillard-reakció menete az Amadori-terméktöl a protein-dikarbonilig. (Fe3+ illetve Fe2+=ferri illetve ferro vas)
A következő lépésben (3. ábra) az enediol, a biológiai rendszerekben mindig jelenlévő ferri (Fe 3+ ) vasnak elektront ad le, a glukózból származó szénlánc leválik a fehérjeláncról vagy az aminosavról, és így szabad dialdehidek jönnek létre.13,14 Ezek a rendkívül reakcióképes dialdehidek keletkeznek például egyes fött ételek készítésekor is. A legtoxikusabbak (3-dezoxiglukozon, glioxál és metil-glioxál) közül a metil-glioxál viselkedésének tanulmányozásában jelentős elörelépést tettek Szent-Györgyi Albert és munkatársai is.15 A képződött dialdehidek rendkívül gyorsan reagálnak a környezetükben található aminocsoportokkal, miközben heterociklikus molekulák, pl. imidazolon és pentozidin (4. ábra) termelődik, melyek a glikációs végtermékek közé tartoznak. Másrészt viszont a dialdehidek két, térben közellévő fehérjelánc összekapcsolását is elöidézhetik, ha egy-egy aldehidcsoportjuk a két különböző fehérjén lévö aminocsoporttal lép reakcióba.
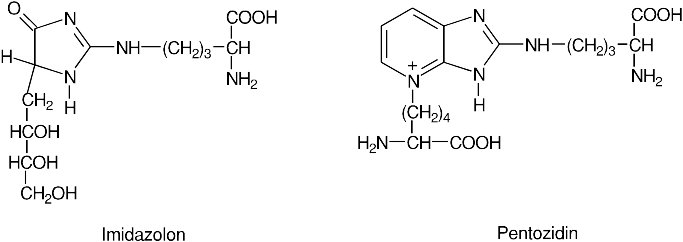
4. ábra: A pentozidin és az imidazolon glikációs végtermékek szerkezeti képlete
A ferri (Fe 3+ ) vas ferro (Fe 2+ ) vassá redukálódása, a glikált molekula elektronleadása (azaz oxidációja) miatt az egész reakciót glikoxidációnak is nevezik. A nem haem-vas az élő szervezetekben általában vas-ATP, vas-ADP, vas-citrát vagy egyéb kelátok formájában fordul elő. Vizsgálataink szerint a vas jelenléte nemcsak teljessé teszi a glikoxidáció folyamatát, hanem fel is gyorsítja azt, katalizátorként működve.16 Adataink arra utalnak, hogy az arginin is képes komplexálni a vasat, így a vas mint katalizátor jelenléte különösképpen felgyorsíthatja ezen aminosav glikációját. A reakciósorban termelődő ferro vas a szövetekben mindig jelenlévő oxigént redukálni képes, és ezzel szuper-oxid szabad gyök keletkezését idézheti elő.17 A szuperoxid szabad gyök spontán is, de még inkább a szuperoxid-dizmutáz enzim hatására hidrogén-peroxiddá alakul. A hidrogén-peroxid a továbbra is képződő ferro vassal újabb reakcióba léphet. Ilyenkor hidroxil szabad gyök vagy lipidperoxidáció alakul ki, és a ferro vas visszaoxidálódik ferri vassá. Ezen szabad gyökös reakciók kölcsönhatását a vassal az 5. ábra foglalja össze.
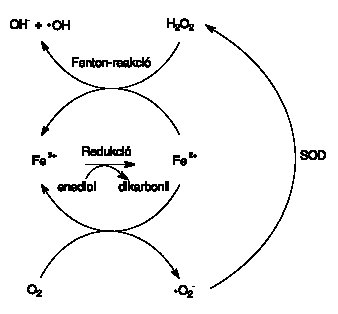
5. ábra: A nem-enzimatikus glikációval kapcsolatban álló szabad gyökös reakciók. (Rövidítéseket lásd a rövíditésjegyzékben)
A Bayer–Villiger-reakcióban a még kötött dialdehid a leírtaknak megfelelően képződő hidrogén-peroxiddal tovább oxidálódik és – egy átmeneti termék képződése után – a szintén glikációs végtermékként számon tartott karboximetil-lizinné vagy acetamid keresztkötéssé alakul át (6. ábra).18
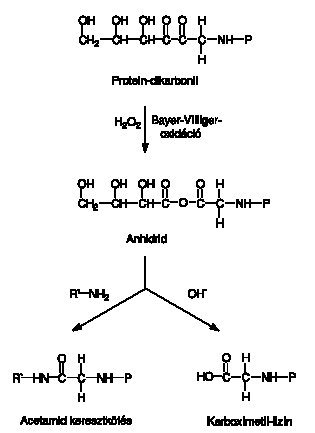
6. ábra: Proteinláncok közötti hídkötés és a glikációs végtermék karboximetil-lizin kialakulása protein-dikarbonil és hidrogénperoxid jelenlétében. Az anhidrid molekula vagy egy újabb protein aminocsoportjával kapcsolódva keresztkötést hoz létre, vagy karboximetil-lizinné alakul. (R’–NH2 = a reakcióba belépő második protein-aminocsoport, lásd még a rövidítésjegyzéket)
Glikálódhat a foszfolipidek közül pl. a foszfatidil-etanolamin aminocsoportja is (7. ábra). Az említett szabad gyökös folyamatok miatt a foszfolipidek glikációja során fokozódhat a lipidperoxidáció.19
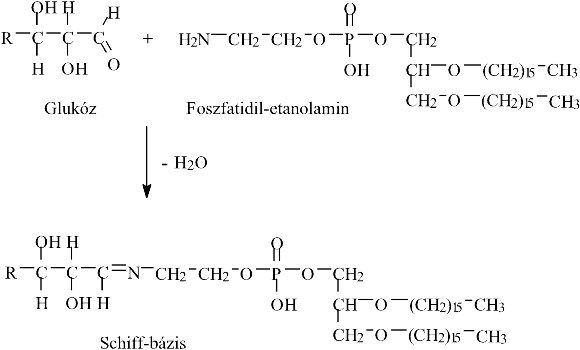
7. ábra: A membrán-alkotó foszfolipid, a foszfatidil-etanolamin glikációja
Az ismertetett kémiai reakciók során fellépő szabad gyökös folyamatok hatására gyakran következik be fehérje- és DNS-degradáció, illetve fehérjepolimerizáció is. Nem meglepő ezért, hogy pl. a karboximetil-lizin képződését nagymértékben befolyásolják az antioxidánsok.20 A karboximetil-lizin képződése pl. specifikus szabadgyök-fogó), szuperoxid-dizmutázzal (amely a szuperoxid szabad gyökböl hidrogén-peroxidot képez), katalázzal (amely a hidrogén peroxidot bontja vízzé), E-vitaminnal (amely a lipidperoxidációt gátolja) és dezferrioxaminnal (amely a ferri vasat komplexálja, megakadályozva a ferro vas kialakulását) is csökkenthető. Gátolja a glikációs végtermékek kialakulását az aminoguanidin is, amely bár szabadgyök-elfogó hatással nem rendelkezik, de a korai glikációs termékekhez kötödve megakadályozza azok továbbalakulását.
A felismert glikációs végtermékek száma rohamosan nő, az említetteken kívül is sokat leírtak már. Egyes becslések szerint több tucat, söt talán több száz is lehet a számuk. Kevéssé ismert azonban, hogy ezek mindegyike fontos-e, vagy vannak kitüntetett patofiziológiai és/vagy klinikai jelentőségű molekulák.
A haemoglobin glikációja
A haemoglobin glikációja során tulajdonképpen a haemoglobin globin láncainak glikációja következik be. Ezen reakció vizsgálata több szempontból is jelentős. Egyrészt, mert a globin láncok alfa ??és beta) glikáltsága információt szolgáltat a diabeteses beteg glykaemiás állapotáról a vizsgálat időpontja előtti 2–3 hónapra visszamenöleg, másrészt a diabeteses komplikációk patogenezisének megértését is elősegíti. A különböző mérési módszerek azonban néha eltérö eredményeket adnak. A diabeteses betegek cukoranyagcseréjének vizsgálatára a legelfogadottabb paraméter a HbA1c . Elgondolkoztató azonban, hogy szintjének mérése a diabetes diagnózisára alkalmatlan 21 és az egészséges populáció egyedeinek eredményei jelentős szórást mutatnak.22 Ennek hátterében, az ismert HbA1c–értéket módosító tényezők mellett (felgyorsult vörösvérsejt-képzés, transzfúzió stb.) felmerül annak lehetősége is, hogy a HbA1c nemcsak a glykaemiát tükrözi. Módosított tömegspektrometriás módszerrel sikerült kimutatni, hogy az egyes globin láncok nem egyformán glikálódnak és a glikációs termékek is különböznek.23 Azonosítottak néhány glikoxidációs terméket is ezeken a fehérjéken. Találtak azonban olyan diabeteses beteget, akinek csak glikációs, és olyat is, akinek csak glikoxidációs termék volt kimutatható a globin láncain. Ráadásul ezzel az érzékeny, rutineljárás során nem használható, tömegspektrometriás módszerrel mért glikáció mérési eredménye majdnem minden esetben alacsonyabb volt, mint a standard rutin módszerként számontartott HPLC által szolgáltatott adat. Felmerül a kérdés, hogy az egyes metodikák vajon milyen mértékben detektálják ezeket a különböző termékeket?
Amit kimutatnak, az mind glikációs termék? Egyáltalán van-e klinikai relevanciája a HbA1c szubfrakciók vizsgálatának? Ezekre a kérdésekre egyelőre nem tudjuk a választ, azonban nagyon érdekes jövöbeli elméleti és klinikai kutatások témái lehetnek.
A glikációs végtermékek mérésére használatos vizsgáló módszerek
Mivel az elmúlt évben egy részletes összefoglaló jelent meg erről a témáról,24 mi csak azokkal a módszerekkel kívánunk foglalkozni, amelyeknek esélyük van arra, hogy a közeljövöben bevonuljanak a klinikai gyakorlatba. Ilyen szempontból három eljárás jön szóba: a glikációs végtermékek immunhisztokémiai kimutatása szövettani metszetekben, valamint testnedvekböl történő identifikálásuk kompetitív ELISA-val vagy fluoreszcens spektometriával.
Immunhisztokémiai módszerrel többen igazolták már különböző szövetekben a glikációs végtermékek jelenlétét.20,25,26 Pentozidin, imidazolon és karboximetil-lizin felszaporodását észlelték a kiszélesedett mesangiumban, a megvastagodott kapilláris- és artériafalban, a nodularis laesióban, a tubulus sejtekben és testszerte az atheroscleroticus laesiókban is. A karboximetil-lizin szöveti szintje a kor előrehaladtával egészségesekben is emelkedik. Az imidazolon magasabb koncentrációja mutatható ki nem diabeteses eredetű vesebántalmakban (minimal change típusú nephrosisban, IgA-nephropathiában, lupus nephritis WHO III. típusában, fokális szegmentális glomerulosclerosisban és végállapotú veseelégtelenségben) a tubulus sejtekben, diabeteses és nem diabeteses uraemiás betegek aortafalában. Immuncitokémiai (immun-elektronmikroszkópos) módszerrel bizonyították, hogy a glikációs végtermékek koncentrációja – a kor előrehaladtával – különös mértékben a vese proximális tubulus sejtjeinek sejtmagjában emelkedik.27
Kompetitív ELISA módszerrel igazolták többek között azt is, hogy egészségesek vizeletében 100 és 1000 Dalton közötti molekulasúlyú glikációs végtermék mutatható ki, amely a veseelégtelenségben szenvedöknél további nagy molekulasúlyú termékkel egészül ki.28 Az AGE mérésére szolgáló immunológiai módszer laboratóriumok közötti nagy variabilitása miatt új eljárást dolgoztak ki, amely a kompetitív ELISA meghatározás során a normál humán serum standard ötszörös hígításával dolgozik.29
A glikációs végtermékek mérésére régóta felhasználják ezen anyagok fluoreszcens tulajdonságát. Már az 1980-as évek óta ismert, hogy a diabetes következtében a vérben fluoreszcens anyag jelenik meg, amelynek excitációs maximuma 350–370 nm, emissziós hullámhossza 440–460 nm között van.30
A kompetitív ELISA módszert és a fluoreszcenciás módszert összehasonlítva:31 a kompetitív ELISA nagyon jól standardizálható, de drága és egyelőre még kevéssé molekulaspecifikus, a fluoreszcencia-vizsgálat viszont olcsó, molekulaspecifikus, de nehezen standardizálható.
A karbonil stressz
A fluoreszcencia felhasználásával 370 nm-es excitációnál és 440 nm-es emissziónál az ún. nem specifikus glikációs végtermékek mérhetök, melyek szabad gyökös károsodás, pl. irradiáció vagy hidrogén-peroxid okozta fehérjemódosítás eredményeként is keletkezhetnek.30,32 Nem meglepő ez az átfedés, ugyanis a szövetek szabad gyökös károsodása során ugyanúgy reaktív aldehidek termelődnek, mint a nem-enzimatikus glikáció folyamatában. Éppen ezért – a közös kémiai háttér miatt – a glikációt és a szabad gyökös károsodást együttesen karbonil stressznek is nevezzük.33 A szabad gyökök által okozott oxidatív stressz során – többek között – két reaktív dialdehid, malondialdehid és 4-hidroxi-nonenal is termelődik. Arra is fény derült, hogy a malondialdehid nemcsak a lipidperoxidáció végterméke, hanem aminosavak, söt szénhidrátok szabad gyökös károsodása során is termelődhet.34 Ez a dialdehid ugyanolyan reakcióképes a szabad aminocsoportokkal, mint a metil-glioxál, mert fehérjékkel és aminosavakkal kémiai kötést hoz létre.35
Az említetteken kívül az autooxidációra képes aszkorbinsav és a szabad arachidonsav is képes a glikációs végtermékhez hasonló fluoreszcens termékek képzésére fehérjék jelenlétében. Talán ez is a magyarázata annak, hogy a szabadgyök-fogóként ismert aszkorbinsav miért nem mindig kedvező hatású.36 Összefoglalva a karbonil stressz jellemző tulajdonságait a következők állapíthatók meg:
1. A nem-enzimatikus glikáció során szabad gyökök termelődnek, melyek az oxidatív stressz miatt szöveti károsodást okozhatnak (pl. lipidperoxidációt).
2. A glikációtól függetlenül létrejövő szöveti oxidatív stressz egyrészt a keletkezett szabad gyökök révén (pl. a szuperoxid szabad gyökböl képződö hidrogén-peroxid a Bayer–Villiger-oxidáció során) gyorsítja a glikáció folyamatát, másrészt a reakció során képződött reaktív aldehideken (pl. malondialdehid) keresztül a glikációhoz hasonló aminocsoport-módosítást okoz.
3. A nem-enzimatikus glikáció súlyos következményekkel járó circulus vitiosust indíthat meg azáltal, hogy a környezetében hidroxil szabad gyök termelést indukál, amely további glukózmolekulákat aktivál a glikációhoz.
4. A klinikai rutinban jelenleg használt vizsgálati módszerekkel meghatározott egyes glikoxidációsnak tünő termék származhat a szövetek nem-glikációs, szabad gyökös károsodásából, és ez zavarhatja a glikáció megítélését.
A nem-enzimatikus glikáció patofiziológiája (8. ábra)
Az élettani folyamatokat a glikációs termékek szervezetbe történő bevitelének, a szervezetben végbemenő keletkezésének és eliminációjának egyensúlya jellemzi. Ezen egyensúly felborulása a glikációs termékek felszaporodásához vezet.

8. ábra: A glikációs végtermékek fokozott bevitele, termelődése és visszatartása a szervezetben circulus vitiosus kialakulásához vezet
A glikációs termékek szervezetbe történő bevitele
Immunológiai módszerrel sikerült igazolni, hogy a táplálékok különböző mennyiségű glikációs terméket tartalmaznak. Különösen megemelkedik mennyiségük a konyhatechnikai elökészítés, a hökezelés hatására. Humán vizsgálatok kimutatták, hogy ezek a glikációs termékek az ételek elfogyasztása után megjelennek a vérkeringésben is, azaz a glikációs termékek nem bomlanak le a gastrointestinalis traktusban lévő emésztő enzimek hatására, hanem intakt állapotban felszívódnak.37 Tehát az ételekben lévő glikációs termékek mennyisége mellett a gastrointestinum állapota is befolyásolja a keringésbe kerülő glikációs termékek mennyiségét.
A kívülröl bevitt glikációs termékek másik forrása a dohányfüst. A dohányfüstben reaktív aldehideket lehet kimutatni.38 Ezek az aldehidek glikációs termékszerű molekulák keletkezését indukálják a dohányfüstben, amelyek inhaláció révén a tüdön keresztül kerülnek be a keringésbe.39
A glikációs termékek keletkezése a szervezetben
A nem-enzimatikus glikáció folyamatosan zajlik a szervezetben, a keringésben, a sejtekben és az interstitialis térben. Mivel kémiai reakcióról van szó, a képződés sebessége a glukóz koncentrációjával arányos. Normoglykaemia esetében is számolnunk kell a glikációval, és ezért glikációs termékek a nem-diabeteses egyénekben is kimutathatók. A szervezet öregedésének egyik fő oka jelen tudásunk szerint éppen a glikációs és glikoxidációs folyamatok jelenléte. A glikációs termékek szintje a kor előrehaladtával folyamatosan emelkedik, elsősorban az egyes szervek lassan megújuló fehérjéiben – mint amilyen pl. a bőr vagy más szervek fehérjetermészetű kötöszöveti állománya.20,28,40 Ezen kötöszöveti fehérjék a glikáció következtében elveszítik normális fiziko-kémiai tulajdonságaikat, hidráltságuk, oldékonyságuk megváltozik, ami a kötöszövet rugalmasságának csökkenésével jár együtt.41 A glikált kötöszöveti fehérjék a kötöszövet megújításában szerepet játszó fehérjeemésztő enzimekkel szemben rezisztensebbé válnak, és így még tovább perzisztálnak.42 Talán ilyen és ehhez hasonló jelenségek vezetnek az idősödő emberek börének ráncosodásához.
A glikációs termékek felvétele a sejtekbe (AGE-receptorok)
A vérben termelődő vagy a keringésbe a gastrointestinumból és a tüdöböl (a dohányzással) bejutó, fehérjékhez kötött glikációs termékek 93%-át a máj veszi fel.43 Hozzávetölegesen 60% a máj endothelsejtjeibe, 25% a Kupffer-sejtekbe és 10–15% a máj parenchyma sejtjeibe kerül. Ezen sejtek receptorain keresztül zajlik a glikációs termékek felismerése és endocytoticus bekebelezése. Hasonló tulajdonságú scavanger receptorok a macrophagok felszínén is megtalálhatók; ezek az oxidált és acilált LDL-t is megkötik, így jelentős szerepet játszanak az atherosclerosis kialakulásában. 44 Két alosztálya ismert ezen macrophag scavanger receptoroknak. Glikációs terméket vehet fel még sok más receptor is, mindenekelőtt az ún. RAGE (az a receptor, amely az AGE-t képes megkötni).45 Pontosan nem tudjuk, hogy a receptorok milyen molekularészt ismernek fel, de mesterségesen előállított fehérjékkel (elsősorban albuminnal) végzett kísérletek arra utalnak, hogy a proteinek formaldehiddel vagy metil-glioxállal történő módosítása során keletkezik olyan termék, amely megindítja a receptorkötödést.46 Ezek a proteinek mind polianionná válnak, az ez okozta töltésváltozás valószínűleg fontos szerepet játszik receptoriális felvételükben, mert egészen más struktúrájú polianionok is szerepelnek ezen receptorok szubsztrátjai között.
Az elmúlt években a macrophagok felszínén található scavanger receptorokat azonosították, és kiderült, hogy a korábban p60-nak nevezett receptor nem más, mint az OST-48, 47 a p90 pedig a 80 K-H 48 jelzésű fehérje. Az OST-48-at korábban a durva felszínű endoplasmaticus reticulumban mutatták ki, a 80 K-H-ról pedig kiderült, hogy a protein-kináz-C szubsztrátja. Ez utóbbi azért is fontos, mert a protein-kináz-C fontos tagja az intracelluláris jelátvitelnek, ami arra utal, hogy a glikációs végtermékek által kiváltott aktiváció beleavatkozik az intracelluláris foszforilációs kaszkád rendszerekbe is. Kimutatták azt is, hogy a macrophagok galectin-3 nevű felszíni fehérjéje is megköti a glikációs termékeket.49
A p60 és p90 típusú glikációs végtermék receptorokat T-lymphocytákon, endothel-, mesangium-, fibroblast- és simaizomsejteken is sikerült detektálni.50
Patológiás állapotokban (diabetes mellitusban, gyulladásos és nem-gyulladásos vesebetegségekben) fokozott mértékben expresszálódnak az AGE-receptorok (RAGE) a vese különböző sejtjein, pl. a mesangiumsejteken, a vese vascularis és glomerularis endothel-, valamint simaizomsejtjein, capsularis epithel- és podocytasejtjein, valamint a proximalis tubulusok sejtjein is.51
Az egyedfejlődés korai szakában a központi idegrendszer sejtjein normálisan megfigyelhető a glikációs termékek receptorainak jelenléte.52 Fokozott expressziója detektálható autoimmun betegekben (SLE), vagy akkor is, ha endotoxin jut a keringésbe,53 illetve Alzheimer-kórban.54 A RAGE expresszióját a tumor nekrózis faktor-a fokozni képes.55
A glikációs termékek receptorainak aktivációja – ismeretlen mechanizmussal – intracelluláris szabadgyök-képződéshez vezet. Azt biztosan tudjuk, hogy ez az intracelluláris, receptor mediálta szabadgyök-képződés független a glikációs termékek molekuláris átrendeződésekor kialakuló szuper-oxid szabad gyök termeléstöl. A p21 ras /mitogén aktiválta protein (MAP) kináz rendszer aktivitása nő a glikációs termékek hatására.56 Ennek az intracelluláris foszforilációs jelátviteli rendszernek a szabályozását a sejtek redox regulációja végzi.57 A MAP kináz rendszer foszforilálja a nukleáris faktor-kappaB (NF-kappaB) inhibitor (I-kappaB) molekularészletét, amire az proteolízis révén leválik az NF-kappaB-röl. Az aktív NF-kappaB ezután a citoplazmából a sejtmagba transzportálódik, ahol bizonyos génszakaszokat aktivál.58 Az NF-kappaB által aktivált gének közé tartozik az AGE-receptor génje is.59 Ily módon az AGE-k által indukált AGE-receptor-expresszió bizonyos fokig szabályozza a sejtek – igényekhez igazodó – glikációs termék felvételét. Az intracelluláris szabadgyök-képződés révén sejtkárosodás jön létre, a glikációs termékek termelődésétöl távoli szervekben is. Az NF-kappaB aktivációjának megelőzésére eredményesen használták in vitro rendszerben a szulfhidrilcsoportot tartalmazó, szabadgyökelfogó hatású liponsavat. 60
A glikációs termékek eliminációja
A glikációs termékek hatása az atherosclerosis kifejlődésére (9. ábra)
Az endothelsejtek felveszik a máj Kupffer-sejtjei által már részben lebontott glikációs végtermékeket és utána gyakorlatilag változatlan formában továbbítják a subendothelialis térbe. Ez a folyamat hasonlóan megy végbe, mint a hormonok endothelialis transcytosisa (pl. inzulin), ezért feltehető, hogy mindkettöben az endotheliumsejt caveolaris membránja vesz részt. Ha így van, akkor nem meglepő, hogy a glikációs végtermékek befolyásolják az endothelsejtek nitrogén-monoxid-termelését is, hiszen az endothelialis típusú nitrogén-monoxid-szintáz enzim a caveolaris membránhoz kötött.

9. ábra: A glikációs termékek szerepe az atherosclerosis kialakulásában. (Rövidítéseket lásd a rövidítésjegyzékben)
A változatlan állapotban a subendothelialis térbe kerülő glikációs végtermékek az extracelluláris tér fehérjéinek módosításához vezetnek, és az endothelsejtekben adhéziós molekulák (VCAM-1, ICAM-1) termelését indítják meg. Ez utóbbiak hatására a macrophagok kitapadnak az endothelre, majd a subendothelialis térbe vándorolnak. A keringésben lévő és az interstitialis térbe bevándoroló monocyta-macrophag rendszer sejtjei bekebelezik a glikációs végtermékeket és átalakítják azokat.61
Az inzulin koncentrációfüggöen fokozza a macrophagok glikációs végtermék felvételét, ami további adalék lehet a hyperinsulinaemia kedvezötlen hatásait illetően.62 Ha a glikált fehérje-molekula az LDL Apo-B apoproteinje, akkor a macrophagok fokozott aktivitással veszik fel az LDL-t, miközben az atherosclerosisra jellemző habos sejtekké (foam cells) alakulnak át.63
A glikált fehérjék degradálódása során a glikációs végtermékek nem detoxifikálódnak a macrophagokban, hanem kis molekulasúlyú lebomlási termékekké alakulnak át (LMW-AGE).64 A glikációs végtermék fragmentumai eljutnak az ér mélyebb rétegeibe is, aktiválják az ott levő simaizom-sejteket, melyek kötöszöveti fehérje-túlprodukcióval, proliferációval és citokin, illetve növekedési faktor termelésével reagálnak. A megszaporodott érfali kötöszöveti állomány fokozottan ki van téve a glikációs lebomlási termékek hatásának, aminek következtében patológiás fehérje–fehérje összekapcsolódás, fehérjefragmentáció, töltés- és oldékonysági változások lépnek fel.
Az endothelsejt, a hozzá kötödő glikált vörösvértestek hatására áteresztövé válik, így a plazma-fehérjék egy része – különösen az albumin – átjut az interstitialis térbe.65 A glikált interstitialis fehérjék és a glikált plazmafehérjék egymással reakcióba lépnek, ami tovább fokozza az érfal merevségét, megvastagodását, a lumen beszűkülését és az endothel lumen felöli felszínének thrombogen átalakulásához vezet.
Mindezek az eliminációs folyamatok ahelyett, hogy csökentenék, inkább fokozzák a glikációs végtermékek toxicitását, hiszen a degradáció során, a molekulasúly csökkenésével ezek a termékek még mobilisabbakká válnak.
A glikációs termékek szerepe a diabeteses nephropathia kialakulásában (10. ábra)
A glikációs fehérjefragmentumok egyedüli, valódi eliminációs szerve a vese. Mint már említettük, a vese proximalis tubulussejtjei nagy számban expresszálnak AGE-receptort (RAGE). Állatkísérletes adatok szerint a glikációs fehérjefragmentumok – a kis molekulasúlyú fehérjékhez (pl. inzulin) hasonló módon – szabadon filtrálódnak át a glomerulusokon, a proximalis tubulusok felszínén lévö AGE-receptorokhoz kötödnek, a tubularis sejtekbe reabszorbeálódnak, és tovább degradálódnak.66,67 A vérben keringő glikációs termékek a glomerulus bazális membránján (GBM) való átjutás során kapcsolódhatnak a membrán fehérjéihez. Az ott in situ termelődő dialdehidek a GBM fehérjéi között kereszthidakat létesíthetnek. Ezek a folyamatok a GBM normális negatív töltését csökkenthetik azáltal, hogy egyrészt a membránhoz kötött heparinoidok mennyiségét mérséklik, másrészt a termelődő szabad gyökök a negatív töltésű sziálsavmaradékok lehasadását okozzák. A keresztkötések létrejötte a pórusátmérő növekedéséhez vezethet. A vérben keringő fehérjéknek a GBM-hez való kötödése a membrán megvastagodását okozza. A glomerularis endothelsejtek – hasonlóan a vascularis atherosclerosis patomechanizmusánál leírtakhoz – fokozottan áteresztövé válnak, ami fontos szerepet játszik a proteinuria kialakulásában és progressziójában.
A termelődött szuperoxid szabad gyök, a vese haemodinamikájának regulációjában fontos nitrogén-monoxidot hatástalanítja, illetve sejt toxikus peroxinitritet képez. A mesangiumsejtek a glikációs termékek hatására fokozzák extracelluláris mátrix fehérje termelésüket, ami mesangialis expanzióhoz vezet.68 A mesangiumsejtek emellett, hasonlóan a simaizomsejtekhez, citokineket és növekedési faktorokat is termelnek, amelyek szerepet játszhatnak a glomerularis hypertrophia, hiperfiltráció és a proteinuria kialakulásában.69 A mesangiumsejt normális viszonyok között az intraglomerularis nyomás szabályozásának egyik fontos szereplöje, mert sima-izomszerüen viselkedve kontrakcióra és relaxációra képes. Ha a glikációs termékek lerakódása miatt megnő a sejtekben a szabad gyökök koncentrációja, akkor elveszíthetik relaxációs képességüket.

10. ábra: A glikációs termékek szerepe a diabeteses nephropathia kialakulásában. (GBM = glomerulus bazális membrán)
A glikációs termékek klinikuma
A glikációs végtermékekkel kapcsolatos klinikai tanulmányok ez idáig elsősorban a diabeteses nephropathia progressziójának és az uraemiás szövődmények kialakulásának vizsgálatára korlátozódtak.
Diabeteses nephropathia 48, 1. típusú diabetesben szenvedő beteg esetében szoros korrelációt mutattak ki a szénhidrát-anyagcsere egyensúlya és a glikációs végtermék képződése között.70 A diabetes fennállásának időtartama, a vizelet albuminürítés mennyisége és a diabeteses retinopathia súlyossága is szignifikáns korrelációt mutatott a börben lévő kollagén glikációjának mértékével.
Egy másik vizsgálatban, ugyancsak 1. típusú diabetesben szenvedök (n=18) 2,5 éves követése előtt és után nyert vesebiopsiás mintáinak szövettani, morfometriás elemzése, igazolta, hogy a kiindulási serumban a glikációs végtermékek szintje elöre jelezheti a GBM megvastagodásának és a mátrix-expanzió növekedésének ütemét.71
A Collaborative Study Group’s Trial vizsgálata szerint 1. típusú diabetesben (n=134) – függetlenül attól, hogy a betegek szedtek-e ACE-inhibitort, vagy sem – a 4 éves követési idő kezdetekor mért emelkedett serum szabad pentozidin szint elöre jelezte a vesefunkció romlását.72 2. típusú diabetesben megbetegedettek (n=74) vizsgálatával is igazolták, hogy a plazma pentozidin koncentráció korrelál a serum creatinin szinttel. Normális vesefunkció esetén a pentozidin koncentrációja jól korrelált a glykaemiás kontrollal, a beteg életkorával, a diabetes időtartamával, a serum cholesterin és az LDL-cholesterin szinttel. A hypertoniások és az ischaemiás szívbetegségben szenvedök pentozidin szintje magasabb volt, mint a kontrolloké.73
Kisszámú 1. típusú diabetesben megbetegedett személyen végzett vizsgálat szerint a tápláléknak a gastrointestinumból felszívódó glikációs végtermékei egyre kevésbé eliminálódnak a diabeteses nephropathia progressziójával párhuzamosan.37
Diabeteses nephropathiás és nem-diabeteses vesebetegek szérumában és vizeletében nagy molekulasúlyú – valószínűleg proteinhez kötött – és kis molekula súlyú, ún. szabad glikációs végtermékek mennyiségének növekedését figyelték meg.28
A nem-enzimatikus glikáció gyógyszeres gátlására elsöként használt aminoguanidin humán vizsgálatban csökkentette a haemoglobin glikációs végtermék mennyiségét, amit a serum cholesterin, az LDL-cholesterin és a tryglicerid koncentrációjának csökkenése is kísért.74 Az aminoguanidin hatását elemző nagy, nemzetközi, multicentrikus vizsgálatot nem fejezték be.
100 mg/nap dózisú aszpirin adásával is próbálták befolyásolni az AGE keletkezését. Egyéves követés után a bőr kollagén pentozidin tartalma csökkent, azonban a retinopathia, a neuropathia vagy a nephropathia progressziója nem változott. Utóbbi adatok értékelhetöségét jelentős mértékben csökkenti a kis betegcsoport (n=24), amelyet három alcsoportra osztottak a terápia alapján, placebóval, aszpirinnel és bázikus aminosavval kezeltekre.75
Uraemia és vesepótló kezelések
Az uraemiás betegek vérében a glikációs termékek kiürítési képtelensége miatt a glikációs végtermékek szintje sokszorosára emelkedik, akkor is, ha nem diabetesesek. A glikáció károsítja a dializáltak 2-microglobulinját is. Ez a módosított fehérje tehető felelőssé a dializáltak amyloidosisáért. 76
A hövel sterilizált peritonealis dializáló oldat, amely magas glukózkoncentrációjú, a hökezelés következtében olyan glukózlebomlási termékeket tartalmazhat, amelyek toxikusak lehetnek a peritonealis felszín sejtjeire.77
Bár a hemodialízis és a peritonealis dialízis is csökkenti a szabad pentozidin szintet, de az még mindig sokszorosa marad a normális koncentrációnak.
A vesetranszplantáció az egyetlen módszer, amellyel normalizálni lehet az uraemia okozta serum pentozidin szint emelkedést.78
IRODALOM
1. Maillard, LC: Synthese des matieres humiques par action des acides amines sur les sucres reducteurs. Ann Chim 5:258–317, 1916.
2. Mohammad, A, Fraenkel-Conrat, H, Olcott, HS: The „browning” reaction of proteins with glucose. Arch Biochem 22: 157–178, 1949.
3. Lewis, VM, Lea, CH: A note on the relative rates of reaction of several reducing sugars and sugar derivatives with casein. Biochim Biophys Acta 4: 532–534, 1950.
4. Rooney, LW, Salem, A, Johnson, JA: Studies of the carbonyl compounds produced by sugar-amino acid reactions. I. Model systems. 44: 539–550, 1967.
5. Johnson, JA, Miller, BS: Browning of baked products. Baker’s Dig 35: 52–59, 1961.
6. Rothe, M, Thomas, B: Über Bildung, Zusammensetzung und Bestimmung von Aromastoffen des Brotes. Die Nahrung 3: 1–17, 1959.
7. Linko, Y-Y, Johnson, JA: Changes in amino acides and formation of carbonil compounds during baking. J Agr Food Chem 11: 150–152, 1963.
8. Goering, KJ, Brelsford, DL: New starches. I. The unusual properties of the starch from Saponaria vaccaria. Cereal Chem 43: 127–136, 1966.
9. Allen, DW, Schroeder, WA, Balog, J: Observations on the chromatographic heterogeneity of normal adult and fetal human hemoglobin: a study of the effects of crystallization and chromatography on the heterogeneity and isoleucin content. J Amer Chem Soc 80: 1628–1634, 1958.
10. Rahbar, S, Blumenfeld, O, Ranney, HM: Studies of an unusual hemoglobin in patients with diabetes mellitus. Biochem Biophys Res Comm 36: 838–843, 1969.
11. Hunt, JV, Bottoms, MA, Mitchinson, MJ: Oxidative alterations in the experimental glycation model of diabetes mellitus are due to protein-glucose adduct oxidation. Biochem J 291: 529–535,1993.
12. Wagner Z, Wittmann I, Pótó L, Wagner L, Belágyi J, Nagy J: Glukóz szabad gyök képződése hidroxil szabad gyök jelenlétében. Diabetologia Hungarica 4: 205–211, 1998.
13. Hayase, F, Shibuya, T, Sato, J, Yamamoto, M: Effects of oxygen and transition metals on the advanced Maillard reaction of proteins with glucose. Biosci Biotech Biochem 60: 18201825, 1996.
14. Niawa, T: ?2 -microglobulin dialysis amyloid and its formation: Role of 3-deoxyglucosone and advanced glycation end products. Nephron 76: 373–391, 1997.
15. McLaughlin, JA, Pethig, R, Szent-Györgyi A: Spectroscopic studies of the protein-methylglyoxal adduct. Proc Natl Acad Sci USA 77: 949–951, 1980.
16. Wagner Z, Wittmann I, Pótó L, Wagner L, Belágyi J, Nagy, J: Az arginin glikációjának szabad gyökös mechanizmusa. Hypertonia és Nephrologia (in press).
17. Ortwerth, BJ, James, H, Simpson, G, Linetsky, M: The generation of superoxide anions in glycation reaction with sugars, osones, and 3-deoxyosones. Biochem Biophys Res Comm 245: 161–165, 1998.
18. Elgawish, A, Glomb, M, Friedlander, M, Monnier, VM: Involvement of hydrogen peroxide in collagen cross-linking by high glucose in vitro and in vivo. J Biol Chem 271:12964–12971, 1996.
19. Requena, JR, Ahmed, MU, Fountain, CW, Degenhardt, TP, Reddy, S, Perez, C, Lyions, TJ, Jenkins, AJ, Baynes, JW, Thorpe, SR: Carboxymethylethanolamine, a biomarker of phospholipid modification during the Maillard reaction in vivo. J Biol Chem 272: 17473–17479, 1997.
20. Schleicher, ED, Wagner, E, Nerlich, AG: Increased accumulation of the glycoxidation product N-(carboxymethyl)lysine in human tissues in diabetes and aging. J Clin Invest 99: 457–468, 1997.
21. Peters, AL, Davidson, MB, Schringer, DL, Hasselblad, V: A clinical approach for the diagnosis of diabetes mellitus: an analysis using glycosylated hemoglobin levels. JAMA 276: 1246–1252, 1996.
22. Kilpatrick, ES, Maylor, PW, Keevil, BG: Biological variation of glycated hemoglobin. Diab Care 21: 261–264, 1998.
23. Lapolla, A, Fedele, D, Aronica, R, Garbeglio, M, D`Alpaos, M, Plebani, M, Seraglia, R, Traldi, P: A highly specific method for the characterization of glycation and glyco-oxidation products of globins. Rapid Comm Mass Spectrom 11: 613–617, 1997.
24. Deyl, Z, Miksik I: Post-translational non-enzymatic modification of proteins. I. Chromatography of marker adducts with special emphasis to glycation reactions. J Chromatogr B 699: 287–309, 1997.
25. Niwa, T, Katsuzaki T, Miyazaki, S, Miyazaki, T, Ishizaki Y, Hayase, F, Tatemichi, N, Takei, Y: Immunohistochemical detection of imidazolone, a novel advanced glycation end product, in kidneys and aortas of diabetic patients. J Clin Invest 99: 1272–1280, 1997.
26. Horie, K, Miyata, T, Maeda, K, Miyata, S, Sugiyama, S, Sakai, H, van Ypersele de Strihou, C, Monnier, VM, Witztum, JL, Kurokawa, K: Immunohistochemical colocalisation of glycoxidation products and lipidperoxidation products in diabetic renal glomerular lesions. J Clin Invest 100:2995–3004, 1997.
27. Bendayan, M: Immunocythochemical detection of advanced glycated end products in rat renal tissue as a function of age and diabetes. Kidney Int 54: 438–447, 1998.
28. Dolhofer-Bliesener, R, Lechner, B, Deppisch, R, Ritz, E, Gerbitz, KD: Immunological determination of advanced glycosylation end-products in human blood and urine. Nephrol Dial Transplant 10: 657–664, 1995.
29. Mitsuhashi, T, Vlassara, H, Founds, HW, Li, MY: Standardizing the immunological measurement of advanced glycation endproducts using normal human serum. J Immunol Methods 207: 79–88, 1997.
30. Jones, AF, Lunec, J: Protein fluorescence and its relationship to free radical activity. Br J Cancer 55(Suppl. 8): 60–65, 1987.
31. Münch, G, Keis, R, Wessels, A, Riederer, P, Bahner, U, Heidland, A, Niawa, T, Lemke, H-D, Schinzel, R: Determination of advanced glycation end products in serum by fluorescence and competitiv ELISA. Eur J Clin Chem Clin Biochem 35: 669–677, 1997.
32. Baynes, JW: Role of oxidative stress in development of complications in diabetes. Diabetes 40: 405–412, 1991.
33. Lyons, TJ, Jenkins, AJ: Lipoprotein glycation and its metabolic consequences. Curr Opin Lipidol 8: 174–180, 1997.
34. Gutteridge, JM: Thiobarbituric acid-reactivity following iron-dependent free radical damage to amino acids and carbohydrates. FEBS Lett 128: 343–346, 1981.
35. King, TP: Selective chemical modification of arginyl residues. Biochemistry 5: 3454–3459, 1966.
36. Hunt, JV, Wolff, SP: Is glucose the sole source of tissue browning in diabetes mellitus? FEBS Lett 269: 258–260, 1990.
37. Koschinsky, T, He, C–J, Mitsuhashi, T, Bucala, R, Liu, C, Buenting, C, Heitmann, K, Vlassara, H: Orally absorbed reactive glycation products (glycotoxins): An enviromental risk factor in diabetic nephropathy. Proc Natl Acad Sci USA 94: 6474–6479, 1997.
38. Nagy J, DeMaster, EG, Wittmann I, Schultz, P, Raij, L: Induction of endothelial cell injury by cigarette smoke. Endothelium 5: 251–263, 1997.
39. Cerami, C, Founds, H, Nicholl, I, Mitsuhashi, T, Giordano, D, Vanpatten, S, Lee, A, Al-Abed, Y, Vlassara, H, Bucala, R, Cerami, A: Tobacco smoke is a source of toxic reactive glycation products. Proc Natl Acad Sci USA 94: 13915–13920, 1997.
40. Verbeke, P, Perichon, M, Borot-Laloi, C, Schaeverbeke, J, Bakala, H: Accumulation of advanced glycation endproducts in the rat nephron: link with circulation AGEs during aging. J Histochem Cytochem 45: 1059–1068, 1997.
41. Vlassara, H, Bucala, R, Striker, L: Pathogenic effects of advanced glycosylation: bichemical, biologic, and clinical implications for diabetes and aging. J Lab Invest 70: 138–151, 1994.
42. Vlassara, H: Recent progress in advanced glycation end products and diabetic complications. Diabetes 46(Suppl. 2): S19–S25, 1997.
43. Smedsrod, B, Melkko, J, Araki, N, Sano, H, Horiuchi, S: Advanced glycation end products are eliminated by scavanger-receptor-mediated endocytosis in hepatic sinusoidal Kupffer and endothelial cells. Biochem J 322: 567–573, 1997.
44. Melkko, J, Hellevik, T, Risteli, L, Risteli, J, Smedsrod, B: Clearance of NH2-terminal propeptides of type I and III procollagen is a physiological function of the scavanger receptor in liver endothelial cells. J Exp Med 179: 405–412, 1994.
45. Schmidt, AM, Vianna, M, Gerlach, M, Brett, J, Ryan, J, Kao, J: Isolation and characterization of two binding proteins for advanced glycosilation end products from bovine lung which are present on the endothelial cell surface. J Biol Chem 256: 14987–14997, 1992.
46. Takata, K, Horiuchi, S, Araki, N, Shiga, M, Saitoh, M, Morino, Y: Endocytic uptake of nonenzymatically glycosylated proteins is mediated by a scavanger receptor for aldehyde-modified proteins. J Biol Chem 263: 14819–14825, 1988.
47. Silberstein, S, Kelleher, DJ, Gilmore, R: The 48-kDa subunit of the mammalian oligosaccharyltransferase complex is homologous to the essential yeast protein WBP1. J Biol Chem 267: 23658–23663, 1992.
48. Patel, J, Kligman, D: Purification and characterization of an Mr 87,000 protein kinase C substrate from rat brain. J Biol Chem 262: 16686–16691, 1997.
49. Vlassara, H, Li, YM, Imani, F, Wojciechowicz, D, Yang, Z, Liu, FT, Cerami, A: Identification of galectin-3 as a high affinity binding protein for advanced glycation endproducts (AGE), a new member of the AGE-receptor complex. Mol Med 1: 634–646, 1995.
50. Vlassara, H: Protein glycation in the kidney: Role in diabetes and aging. Kidney Int 49: 1795–1804, 1996.
51. Abel, M, Ritthaler, U, Zhang, Y, Deng, A, Schmidt, AM, Greten, J, Sernau, T, Wahl, P, Andrassy, K, Ritz, E, Waldherr, R, Stern, DM, Nawroth, PP: Expression of receptors for advanced glycosylated end-products in renal disease. Nephrol Dial Transplant 10: 1662–1667, 1995.
52. Hori, O, Brett, J, Slattery, T, Cao, R, Zhang, J, Chen, JX, Nagashima, M, Lundh, ER, Vijay, S, Nitecki, D: The receptor for advanced glycation endproducts (RAGE) is a cellular binding site for amphoterin. Mediation of neurite outgrowth and co-expression of RAGE and amphoterin in the developing nervous system. J Biol Chem 270: 25752–25761, 1995.
53. Li, J, Schmidt, AM: Characterization and functional analysis of the promoter of RAGE, the receptor for advanced glycation end products. J Biol Chem 272: 16498–16506, 1997.
54. Yan, SD, Chen, X, Fu, J, Chen, M, Zhu, H, Roher, A, Slattery, T, Zhao, L, Nagashima, M, Morser, J, Migheli, A, Nawroth, P, Stern, D, Schmidt, AM: RAGE and amyloid-beta peptide neurotoxicity in Alzheimer’s disease. Nature 382: 685–691, 1996.
55. Ritthaler, U, Deng, Y, Zhang, Y, Greten, J, Abel, M, Sido, B, Allenberg, J, Otto, G, Roth, H, Bierhaus, A, Ziegler, R, Schmidt, AM, Waldherr, R, Wahl, P, Stern, DM, Nawroth, PP: Expression of receptors for advanced glycation end products in peripheral occlusive vascular disease. Am J Pathol 146: 688–694, 1995.
56. Lander, HM, Tauras, JM,. Ogiste, JS, Hori, O, Moss, RA, Schmidt, AM: Activation of the receptor for advanced glycation end products triggers a p21ras-dependent mitogen-activated protein kinase pathway regulated by oxidant stress. J Biol Chem 272: 17810–17814, 1997.
57. Lander, HM, Ogiste, JS, Teng, KK, Novogrodsky, A: p21ras as a common signaling target of reactive free radicals and cellular redoc stress. J Biol Chem 270: 21195–21198, 1995.
58. Palmer, H, Paulson, KE: Reactive oxigen species and antioxidants in signal transduction and gene expression. Nutr Rev 55: 353–361, 1997.
59. Li, J, Schmidt, AM: Characterization and functional analysis of the promoter of RAGE, the receptor for advanced glycation end products. J Biol Chem 272: 16498–16506, 1997.
60. Bierhaus, A, Chevion, S, Chevion, M, Hofmann, M, Quehenberger, P, Illmer, T, Luther, T, Berentshtein, E, Tritschler, H, Müller, M, Wahl, P, Ziegler, R, Nawroth, PP: Advanced glycation end product-induced activation of NF-kappaB is suppressed by a-lipoic acid in cultured endothelial cells. Diabetes 46: 1481–1490, 1997.
61. Vlassara, H, Fuh, H, Donelly, T, Cybulsky, M: Advanced glycation end products promote adhesion molecule (VCAM–1, ICAM–1) expression and atheroma formation in normal rabbits. Mol Med 1: 447–456, 1995.
62. Sano, H, Higashi, T, Matsumoto, K, Melkko, J, Jinnouchi, Y, Ikeda, K, Ebina, Y, Makino, H, Smedsrod, B, Horiuchi, S: Insulin enhances macrophage scavanger receptor-mediated endocytotic uptake of advanced glycation end products. J Biol Chem 273: 8630–8637, 1998.
63. Hori, O, Yan, SD, Ogawa, S, Kuwabara, K, Matsumoto, M, Stern, D, Schmidt, AM: The receptor for advanced glycation end-products has a central role in mediating the effects of advanced glycation end-products on the development of vascular disease in diabetes mellitus. Nephrol Dial Transplant 11(Suppl. 5): 13–16, 1996.
64. Vlassara, H, Bucala, R: Recent progresses in advanced glycation and diabetic vascular disease: Role of advanced glycation end product receptors. Diabetes 45(Suppl. 3): S65–S66, 1996.
65. Schmidt, AM, Hori, O, Cao, R, Yan, SD, Brett, J, Wautier, J-L, Ogawa, S, Kuwabara, K, Matsumoto, M, Stern, D: RAGE-a novel cellular receptor for advanced glycation end products. Diabetes 45(Suppl. 3): S77–S80, 1996.
66. Gugliucci, A, Bendayan, M: Renal fate of circulating advanced glycated end products (AGE): Evidence for reabsorption and catabolism of AGE-peptides by renal proximal tubular cells. Diabetologia 39: 149–160, 1996.
67. Miyata, T, Ueda Y, Horie, K, Nangaku, M, Tanaka, S, van Ypersele de Strihou, C, Kurokawa, K: Renal catabolism of advanced glycation end products: The fate of pentosidine. Kidney Int 53: 416–422, 1998.
68. Yang, C-W, Vlassara, H, Peten, EP, He, C-J, Striker, GE, Striker, LJ: Advanced glycation end products upregulate gene expression found in diabetic glomerular disease. Proc Natl Acad Sci USA 91: 9436–9440, 1994.
69. Vlassara, H, Striker, LJ, Teichberg, S, Fuh, H, Li, YM, Steffes, M: Advanced glycation end products induce glomerular sclerosis and albuminuria in normal rats. Proc Natl Acad Sci USA 91: 11704–11708, 1994.
70. Beisswenger, PJ, Makita, Z, Curphey, TJ, Moore, LL, Jean, S, Brinck-Johnsen, T, Bucala, R, Vlassara, H: Formation of immunochemical advanced glycosylation end products precedes and correlates with early manifestations of renal and retinal disease in diabetes. Diabetes 44: 824–829, 1995.
71. Berg, TJ, Bangstadt, H-J, Torjesen, PA, Osterby, R, Bucala, R, Hanssen, KF: Advanced glycation end products in serum predict changes in the kidney morphology of patients with insulin-dependent diabetes mellitus. Metabolism 46: 661–665, 1997.
72. Weiss, MF, Rodby, RA, Justice, AC, Hirick, DE, and The Collaborative Study Group: Free pentosidine and neopterin as markers of progression rate in diabetic nephropathy. Kidney Int 54: 193–202, 1998.
73. Sugiyama, S, Miyata, T, Ueda, Y, Tanaka, H, Maeda, K, Kawashima, S, van Ypersele de Strihou, C, Kurokawa, K: Plasma levels of pentosidine in diabetic patients: an advanced glycation end product. J Am Soc Nephrol 9: 1681–1688, 1998.
74. Makita, Z, Vlassara, H, Rayfield, E, Cartwright, K, Friedman, E, Rodby, R, Cerami, A, Bucala, R: Hemoglobin-AGE: a circulating marker of advanced glycosylation. Science 258: 651–653, 1992.
75. Contreras, I, Reiser, KM, Martinez, N, Giansante, E, Lopez, T, Suarez, N, Postalian, S, Molina, M, Gonzalez, F, Sanchez, MR, Camejo, M, Blanco, MC: Effects of aspirin or basic amino acids on collagen cross-links and complications in NIDDM. Diabetes Care 20: 832–835, 1997.
76. Miyata, T, Taneda, S, Kawai, R, Ueda, Y, Horiuchi, S, Hara, M, Maeda, K, Monnier, VM: Identification of pentosidine as a negative structure for advanced glycation end products in ?2 -microglobulin-containing amyloid fibrils in patients with dialysis-related amyloidosos. Proc Natl Acad Sci USA 93: 2353–2358, 1996.
77. Wieslander AP: Cytotoxicity of peritoneal dialysis fluidis it related to glucose breakdown products? Nephrol Dial Transplant 11: 958–959, 1996.
78. Miyata, T, Ueda, Y, Yoshida, A, Sugiyama, S, Iida, Y, Jadoul, M, Maeda, K, Kurokawa, K, van Ypersele de Strihou, C: Clearance of pentosidine, an advanced glycation end product, by different modalities of renal replacement therapy. Kidney Int 51: 880–887, 1997.